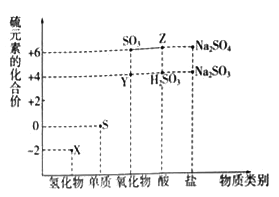
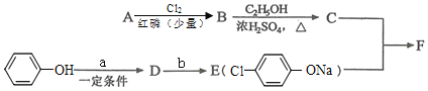
题目内容
【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
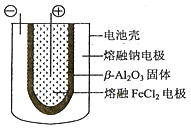
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
【答案】 )第三周期第VIA族 ![]() r(O2-)>r(Na+) HClO4>H2SO4 MgO的熔点高,熔融时耗费更多能源,增加生产成本 AlCl3是共价化合物,熔融态难导电 CH≡CCH3 Mg2C3 Fe2++2e-=Fe 钠 β-Al2O3固体
r(O2-)>r(Na+) HClO4>H2SO4 MgO的熔点高,熔融时耗费更多能源,增加生产成本 AlCl3是共价化合物,熔融态难导电 CH≡CCH3 Mg2C3 Fe2++2e-=Fe 钠 β-Al2O3固体
【解析】分析:本题考查元素周期表和元素周期律、离子化合物和共价化合物、烃结构简式的确定、可充电电池的工作原理。
(1)根据S的原子结构示意图确定S在周期表中的位置,CO2中只含共价键。
(2)根据“层多径大,序大径小”判断离子半径大小。根据元素的非金属性强弱判断最高价氧化物对应水化物酸性强弱。
(3)根据表中信息判断,MgO的熔点高,熔融时消耗更多能源。AlCl3属于共价化合物,熔融态难导电。
(4)根据碳氢质量比计算碳氢原子个数比,根据反应的物质的量和原子守恒确定Q的化学式和烃的结构简式。
(5)可充电电池放电时为原电池工作原理,充电时为电解池工作原理。放电时的负极充电时为阴极,放电时的正极充电时为阳极。
详解:(1)S的原子结构示意图为![]() ,S在周期表中位于第三周期第VIA族。CO2的电子式为
,S在周期表中位于第三周期第VIA族。CO2的电子式为![]() 。
。
(2)O2-、Na+具有Ne的电子层结构,O2-的核电荷数小于Na+,则离子半径:r(O2-)![]() r(Na+)。S、Cl都处于第三周期,同周期从左到右元素的非金属性逐渐增强,最高价氧化物对应水化物酸性逐渐增强,非金属性:S
r(Na+)。S、Cl都处于第三周期,同周期从左到右元素的非金属性逐渐增强,最高价氧化物对应水化物酸性逐渐增强,非金属性:S![]() Cl,S、Cl的最高价氧化物对应水化物的酸性:HClO4
Cl,S、Cl的最高价氧化物对应水化物的酸性:HClO4![]() H2SO4。
H2SO4。
(3)根据表中的信息,MgO和MgCl2都属于离子化合物,MgO的熔点高,MgO熔融时耗费更多能源,增加生产成本,所以工业制镁时电解MgCl2而不电解MgO。Al2O3属于离子化合物,熔融态时能导电,AlCl3属于共价化合物,熔融态难导电,工业制铝时电解Al2O3而不电解AlCl3。
(4)该烃分子中n(C):n(H)=![]() :
:![]() =3:4,碳与镁形成的1mol化合物Q与水反应生成2molMg(OH)2和1mol烃,根据原子守恒,烃的分子式为C3H4,Q的化学式为Mg2C3。烃的不饱和度为2,烃的结构简式为CH3C
=3:4,碳与镁形成的1mol化合物Q与水反应生成2molMg(OH)2和1mol烃,根据原子守恒,烃的分子式为C3H4,Q的化学式为Mg2C3。烃的不饱和度为2,烃的结构简式为CH3C![]() CH。
CH。
(5)放电时的反应为2Na+FeCl2=2NaCl+Fe,放电时正极发生得电子的还原反应,电池的正极反应式为Fe2++2e-=Fe。放电时Na为负极,熔融FeCl2电极为正极;充电时Na为阴极,阴极与外加电源的负极相连,充电时熔融钠电极接电源的负极。根据装置图,该电池的电解质为β-Al2O3固体。

 阅读快车系列答案
阅读快车系列答案【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣。粉煤灰的综合利用具有很大的价值。
(1)煤炭在火炉中燃烧很旺时,在往炉膛内的热煤炭上喷洒少量水的瞬间,炉子内火会更旺。如果烧去同量的煤炭,喷洒过水的和没有喷洒过水的煤炭相比较,它们放出的总热量___(填“相同”或“不相同”)。这是因为:________________________。
(2)研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
①以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。向分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合下表分析其原因:___________________
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~895 | 1.94~3.20 | 3.69~4.8 |
②使用碱性较弱的氨水为pH调节剂,进行分离实验。反应终点的pH对铝和铁分离效果的影响如图1。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是____________。
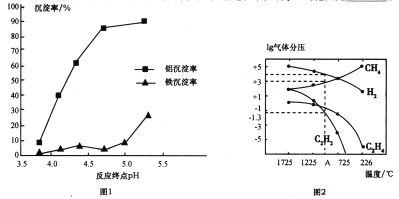
(3)工业上可利用煤的气化产物(水煤气)合成甲烷研究得出,甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图2所示。
①T℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。