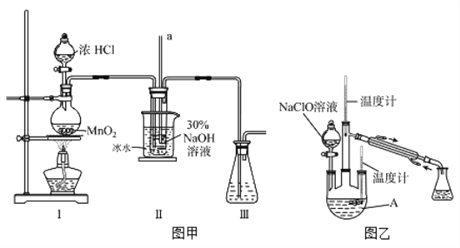
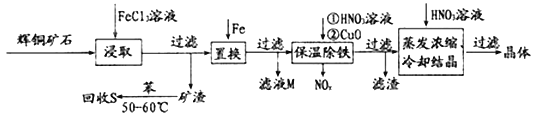
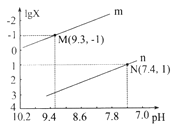
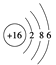
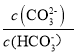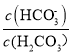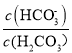题目内容
【题目】短周期主族元素W、X、Y、Z,原子半径依次增大。W、X在同一主族,Y元素在第三周期中离子半径最小,Y和Z的原子序数之和是W的3倍。下列说法正确的是
A. X的简单氢化物的热稳定性比W的强 B. X的氧化物对应的水化物是强酸
C. Z和W形成的化合物可能含有非极性键 D. Z、Y的氧化物是常用的耐火材料
【答案】C
【解析】电子层数越多,半径越大,当电子层数相等时,半径随着原子序数的递增而减小,四种元素的原子半径依次增大,因此四种元素在周期表的位置大概是 ,Y元素在第三周期中离子半径最小,即Y为Al,邻Z的原子序数为a,W的原子序数为b,则X的原子序数为b+8,因此有13+a=3b,因为Y为Al,则Z可能是Na,也可能是Mg,假设Z为Na,b=8,即W为O,X为S,假设Z为Mg,则b=25/3,不符合题意,A、同主族从上到下,非金属性减弱,其氢化物的稳定性减弱,即O的简单氢化物的热稳定强于S,故A错误;B、S的氧化物为SO2和SO3,其对应水化物是H2SO3和H2SO4,H2SO3为中强酸,H2SO4为强酸,故B错误;C、Na和O形成的化合物是Na2O和Na2O2,前者只含有离子键,后者含有离子键和非极性共价键,故C正确;D、钠的氧化物不能用于制作耐火材料,氧化铝可以,故D错误。
,Y元素在第三周期中离子半径最小,即Y为Al,邻Z的原子序数为a,W的原子序数为b,则X的原子序数为b+8,因此有13+a=3b,因为Y为Al,则Z可能是Na,也可能是Mg,假设Z为Na,b=8,即W为O,X为S,假设Z为Mg,则b=25/3,不符合题意,A、同主族从上到下,非金属性减弱,其氢化物的稳定性减弱,即O的简单氢化物的热稳定强于S,故A错误;B、S的氧化物为SO2和SO3,其对应水化物是H2SO3和H2SO4,H2SO3为中强酸,H2SO4为强酸,故B错误;C、Na和O形成的化合物是Na2O和Na2O2,前者只含有离子键,后者含有离子键和非极性共价键,故C正确;D、钠的氧化物不能用于制作耐火材料,氧化铝可以,故D错误。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目