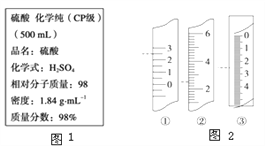
题目内容
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
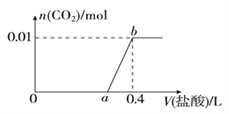
A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
【答案】C
【解析】试题分析:A、在氢氧化钠与碳酸钠的混合液中,先发生氢离子与氢氧根离子的中和反应,再发生碳酸根离子与氢离子生成碳酸氢根离子的反应,所以在0-a范围内,不只发生中和反应,错误;B、a点2,溶液为氯化钠和碳酸氢钠溶液,所以ab段发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,错误;C、根据生成的二氧化碳的物质的量可知原溶液中有0.01mol的碳酸钠,0.01mol的碳酸钠与0.01mol的氢离子反应生成0.01mol的碳酸氢根离子,0.01mol的碳酸氢根离子需要0.01mol的氢离子反应生成0.01mol的二氧化碳,所以生成二氧化碳是消耗盐酸是0.01mol/0.1mol/L=0.1L,即0.4-a=0.1,所以a=0.3,正确;D、碳酸钠的物质的量是0.01mol,生成碳酸氢根离子消耗盐酸的体积是0.1L,则氢氧化钠消耗盐酸的体积是0.3-0.1=0.2L,所以氢氧化钠的物质的量是0.2L×0.1mol/L=0.02mol,原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,错误,答案选C。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】下表所示为某市新设的一组垃圾箱的文字说明。
某市生活垃圾分类种类 | ||
可回收垃圾(A) | 不可回收垃圾(B) | 有害垃圾(C) |
纸类 玻璃 金属 塑料 橡胶 纺织品 | 厨房垃圾 灰土 杂草 枯枝 花卉 | 日光灯管 电池 喷雾罐 指甲油瓶 药瓶 涂改液瓶 |
(1)烂苹果应放入____,废弃光盘应放入_____(填字母)
(2)图示“![]() ”应贴在______(填字母)
”应贴在______(填字母)
(3)为治理“白色污染”,有人提出把塑料垃圾集中,然后集中在露天焚烧,这种处理方法的弊端是______________________________(写出其中一种)
(4)下列关于垃圾处理方法正确的是(____)
A.填埋垃圾不需要技术标准,只需深埋即可
B.废旧电池无需任何处理,只需集中深埋即可
C.废旧玻璃可重新熔炼、再生,重新制玻璃仪器
D.废弃塑料、橡胶、合成纤维等可进行堆肥处理.
【题目】我国农业因酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定数据如下:
时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 |
根据上述材料回答下列问题:(已知Cl2+SO2+2H2O![]() H2SO4+2HCl)
H2SO4+2HCl)
①酸雨有很大的危害,严重威胁着生态环境。酸雨的PH____5.6(填< 或 >)。
②酸雨放置时,pH发生变化的主要原因是(用化学方程式表示)_____________________。
③如果将刚取样的上述雨水与少量新鲜自来水混合,pH将______(填“变大”、“变小”或“不变” )。
(2)你认为以下哪些做法是减少酸雨产生的途径_____________( 填序号)
①少用煤作燃料 ②把烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
(3)十二届全国人民代表大会政府工作报告中强调“加强雾霾治理,淘汰黄标车和老旧车”,下列物质不属于空气污染物的是 (______)
A. CO2 B. SO2 C. NO2 D. PM2.5
(4)改善大气质量、污水处理和实现垃圾的资源化等都要依靠化学等科学的发展。
固体煤气化得到CO和H2,在燃烧时可以大大减少________(填化学式,下同)和烟尘的排放。汽车尾气的主要污染是形成_______________,防止此种污染的措施是将汽车尾气中的CO、NO在催化剂的作用下反应生成无害的CO2和_____。