题目内容
6.K、Al、O、N、S、Cl、Fe是常见的七种元素.(1)S位于元素周期表第三周期第VIA族;Fe的基态原子最外层有2个电子.
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| N>O | O2->Al3+ | KCl>硫黄 | H2SO4<HClO4 |
(4)向KAlO2溶液中不断通入NO2气体,反应的现象为先生成白色沉淀,然后白色沉淀不断溶解,其中涉及氧化还原反应的离子方程式为3NO2+H2O═2H++2NO3-+NO,此反应的氧化剂与还原剂的物质的量之比为1:2.
分析 (1)S是16号元素,在周期表第三周期第VIA族;Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,所以Fe的基态原子最外层有2个电子;
(2)同周期第ⅡA族和第ⅤA元素第一电离能比同周期相邻元素第一电离能高;电子层结构相同核电荷数越多半径越小;离子晶体的熔点高于分子晶体;元素非金属性越强最高价氧化物对应水化物的酸性越强;
(3)向NH4Al(SO4)2溶液中滴加过量的KOH稀溶液,铝离子转化为偏铝酸根离子,所以反应的离子方程式为:NH4++Al3++5OH-═NH3?H2O+AlO2-+2H2O;
(4)二氧化氮与水反应生成硝酸和一氧化氮,硝酸与偏酸反应生成氢氧化铝,继续通往二氧化氮氢氧化铝溶解,二氧化氮与水的反应是自身的氧化还原反应,由此分析解答.
解答 解:(1)S是16号元素,在周期表第三周期第VIA族;Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,所以Fe的基态原子最外层有2个电子,故答案为:三; VIA;2;
(2)同周期第ⅡA族和第ⅤA元素第一电离能比同周期相邻元素第一电离能高,所以第一电离能N>O;O2- 和Al3+的电子层结构相同,但氧的核电荷数小于铝,所以以O2->Al3+;氯化钾是离子晶体而硫是分子晶体,所以熔点:KCl>硫黄;非金属性Cl>S,所以酸性:H2SO4<HClO4,故答案为:>;>;>;<;
(3)向NH4Al(SO4)2溶液中滴加过量的KOH稀溶液,铝离子转化为偏铝酸根离子,所以反应的离子方程式为:NH4++Al3++5OH-═NH3?H2O+AlO2-+2H2O;故答案为:NH4++Al3++5OH-═NH3?H2O+AlO2-+2H2O;
(4)(4)二氧化氮与水反应生成硝酸和一氧化氮,硝酸与偏酸反应生成氢氧化铝,继续通往二氧化氮氢氧化铝溶解,二氧化氮与水的反应是自身的氧化还原反应,方程式为:3NO2+H2O═2H++2NO3-+NO,氧化剂与还原剂的物质的量之比为1:2,
故答案为:先生成白色沉淀,然后白色沉淀不断溶解;3NO2+H2O═2H++2NO3-+NO;1:2.
点评 本题考查了元素周期律和氧化还原反应中离子方程式的书写、有关物质的量的计算等知识点,能正确判断生成物是解本题的关键,难度不大.

| A. | 凡是分子组成相差一个或几个“CH2”原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物的组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 凡是含碳元素的化合物都属于有机化合物 | |
| D. | 有机化合物的同分异构现象是有机化合物种类繁多的重要原因之一 |
| A. | 10℃20 mL 3 mol•L-1的盐酸溶液 | B. | 20℃30 mL 2 mol•L-1的盐酸溶液 | ||
| C. | 20℃20 mL 2 mol•L-1的盐酸溶液 | D. | 20℃10 mL 4 mol•L-1的盐酸溶液 |
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 向NaAlO2溶液中通入过量CO2:2 AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知: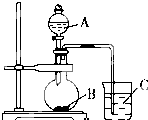 某化学小组设计实验元素周期表中元素的性质,请回答下列问题
某化学小组设计实验元素周期表中元素的性质,请回答下列问题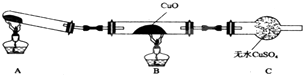 某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.
某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.