题目内容
14.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )| A. | 10℃20 mL 3 mol•L-1的盐酸溶液 | B. | 20℃30 mL 2 mol•L-1的盐酸溶液 | ||
| C. | 20℃20 mL 2 mol•L-1的盐酸溶液 | D. | 20℃10 mL 4 mol•L-1的盐酸溶液 |
分析 相同条件下,温度越高反应速率越快,浓度越大反应速率越快.
解答 解:温度越高反应速率越快,浓度越大反应速率越快,D选项中浓度最大、温度也最高,故所以D最快,故选D.
点评 本题考查化学反应速率的影响因素,侧重于学生的分析、比较能力的考查,注意影响反应速率的外界因素,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
4.1999年4月,比利时查出污染鸡的根源是生产鸡饲料的油脂被二恶英所污染,二恶英是两大芳香族化合物的总称.其中四氯代二苯并二恶英毒性最大,其结构简式为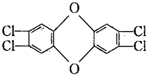 :下列有关该化合物的说法中正确的是( )
:下列有关该化合物的说法中正确的是( )
 :下列有关该化合物的说法中正确的是( )
:下列有关该化合物的说法中正确的是( )| A. | 分子式为C12H8O2Cl4 | B. | 是一种可溶于水的气体 | ||
| C. | 是最危险的致癌物之一 | D. | 是一种多卤代烃 |
5.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 10mL 0.5mol•L-1 CH3COONa 与6mL 1mol•L-1 盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl) |
2.可逆反应达到化学平衡的标志是( )
| A. | 正、逆反应不再进行 | B. | 反应物的浓度为零 | ||
| C. | 反应物的浓度与生成物的浓度相等 | D. | 正、逆反应的速率相等 |
9.某同学用以下装置制备并检验Cl2的性质.下列说法正确的是( )
| A. |  如图:若浓盐酸过量,则理论上MnO2可全部消耗完 | |
| B. |  如图:证明新制氯水只具有酸性 | |
| C. |  如图:产生了棕黄色的雾 | |
| D. |  如图:湿润的有色布条褪色,说明氯气具有漂白性 |
19.500ml 2mol/L的MgCl2溶液中含有氯离子的物质的量是( )
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 1000 mol |
6.K、Al、O、N、S、Cl、Fe是常见的七种元素.
(1)S位于元素周期表第三周期第VIA族;Fe的基态原子最外层有2个电子.
(2)用“>”或“<”填空:
(3)向NH4Al(SO4)2溶液中滴加过量的KOH稀溶液,该反应的离子方程式为NH4++Al3++5OH-═NH3?H2O+AlO2-+2H2O.
(4)向KAlO2溶液中不断通入NO2气体,反应的现象为先生成白色沉淀,然后白色沉淀不断溶解,其中涉及氧化还原反应的离子方程式为3NO2+H2O═2H++2NO3-+NO,此反应的氧化剂与还原剂的物质的量之比为1:2.
(1)S位于元素周期表第三周期第VIA族;Fe的基态原子最外层有2个电子.
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| N>O | O2->Al3+ | KCl>硫黄 | H2SO4<HClO4 |
(4)向KAlO2溶液中不断通入NO2气体,反应的现象为先生成白色沉淀,然后白色沉淀不断溶解,其中涉及氧化还原反应的离子方程式为3NO2+H2O═2H++2NO3-+NO,此反应的氧化剂与还原剂的物质的量之比为1:2.
3.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)?CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2)下列说法正确的是( )
CO(g)+H2O(g)?CO2+H2(g)
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |