题目内容
11.下列实验设计及其对应的离子方程式均正确的是( )| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 向NaAlO2溶液中通入过量CO2:2 AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
分析 A.电子、电荷守恒,反应生成氯化亚铁、氯化铜;
B.电子不守恒;
C.反应生成氢氧化铝和碳酸氢钠;
D.浓盐酸可以被酸性高锰酸钾溶液氧化.
解答 解:A.用FeCl3溶液腐蚀铜线路板的离子反应为Cu+2Fe3+═Cu2++2Fe2+,故A正确;
B.Na2O2与H2O反应制备O2的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故B错误;
C.向NaAlO2溶液中通入过量CO2的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C错误;
D.浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
1.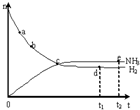 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a时正反应速率比逆反应速率小 | |
| B. | 点d:v正(H2)=3v逆(N2) | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点c处反应达到平衡 |
2.可逆反应达到化学平衡的标志是( )
| A. | 正、逆反应不再进行 | B. | 反应物的浓度为零 | ||
| C. | 反应物的浓度与生成物的浓度相等 | D. | 正、逆反应的速率相等 |
19.500ml 2mol/L的MgCl2溶液中含有氯离子的物质的量是( )
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 1000 mol |
6.K、Al、O、N、S、Cl、Fe是常见的七种元素.
(1)S位于元素周期表第三周期第VIA族;Fe的基态原子最外层有2个电子.
(2)用“>”或“<”填空:
(3)向NH4Al(SO4)2溶液中滴加过量的KOH稀溶液,该反应的离子方程式为NH4++Al3++5OH-═NH3?H2O+AlO2-+2H2O.
(4)向KAlO2溶液中不断通入NO2气体,反应的现象为先生成白色沉淀,然后白色沉淀不断溶解,其中涉及氧化还原反应的离子方程式为3NO2+H2O═2H++2NO3-+NO,此反应的氧化剂与还原剂的物质的量之比为1:2.
(1)S位于元素周期表第三周期第VIA族;Fe的基态原子最外层有2个电子.
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| N>O | O2->Al3+ | KCl>硫黄 | H2SO4<HClO4 |
(4)向KAlO2溶液中不断通入NO2气体,反应的现象为先生成白色沉淀,然后白色沉淀不断溶解,其中涉及氧化还原反应的离子方程式为3NO2+H2O═2H++2NO3-+NO,此反应的氧化剂与还原剂的物质的量之比为1:2.
16.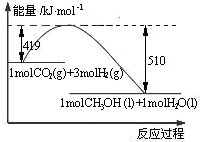 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )| A. | 升高温度 | B. | 分离出甲醇 | ||
| C. | 缩小反应器体积 | D. | 使用合适的催化剂 |
3.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)?CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2)下列说法正确的是( )
CO(g)+H2O(g)?CO2+H2(g)
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
20.以NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 标准状况下,9g H2O与11.2LO2所含的分子数均为0.5 NA | |
| B. | 假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA | |
| C. | 常温下,14gC2H4与C3H6的混合气体中含有的氢原子总数为2NA | |
| D. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
1.等物质的量浓度的下列稀溶液:①CH3COONa溶液;②NaHCO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )
| A. | Na2CO3溶液 | B. | Na2SiO3溶液 | C. | NaOH溶液 | D. | NaHSO3溶液、 |