题目内容
18. 某化学小组设计实验元素周期表中元素的性质,请回答下列问题
某化学小组设计实验元素周期表中元素的性质,请回答下列问题(1)甲同学在a,b,c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,
依次加入大小相近的锂、钠、钾块,观察现象.甲同学设计实验的目的是验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强),反应最剧烈的烧杯是C(填字母).写出b烧杯里发生反应的离子方程式2 Na+2H2O=2Na++2OH-+H2↑
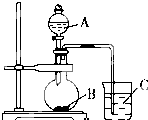
(2)乙同学根据元素的非金属性越强,对应的最高价含氧酸的酸性就越强.设计了如图装置以验证碳、氮、硅元素的非金属性强弱.已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
则实验中所选用物质的化学式:A:HNO3;B:CaCO3;C:Na2SiO3(或K2SiO3).烧杯中发生反应的离子方程式为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑.烧杯中发生反应的离子方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3,实验证明,碳,氦,硅元素的非金属性强弱顺序为氮>碳>硅.
分析 (1)由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;金属性越强,单质与水反应越剧烈;
(2)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,为硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,以此解答.
解答 解:(Ⅰ) ①由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱,
故答案为:验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强);
②金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是C,故答案为:C;
③钠和水反应生成氢氧化钠和氢气,反应的离子方程式为2 Na+2H2O=2Na++2OH-+H2↑,故答案为:2 Na+2H2O=2Na++2OH-+H2↑;
(Ⅱ) ①利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠或硅酸钾,
故答案为:HNO3;CaCO3;Na2SiO3(或K2SiO3);
②烧瓶中发生硝酸与碳酸钙的反应,方程式为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑,故答案为:2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
③二氧化碳可与硅酸钠反应生成硅酸,且生成碳酸钠,如二氧化碳过量,可生成碳酸氢钠,反应的化学方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3,
故答案为:CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3;
④元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性氮>碳>硅,
故答案为:氮>碳>硅.
点评 本题考查性质实验方案的设计,为高频考点,侧重于学生的分析能力和实验能力的考查,本题将元素及其化合物、元素周期律与实验知识结合起来,具有较强的综合性,难度不大.

| A. | 硝酸钾溶于水 | |
| B. | 氨气和氯化氢反应生成氯化铵晶体 | |
| C. | 水蒸气凝结为液态的水 | |
| D. | (NH4)2CO3分解生成二氧化碳、氨气和水 |
| A. |  如图:若浓盐酸过量,则理论上MnO2可全部消耗完 | |
| B. |  如图:证明新制氯水只具有酸性 | |
| C. | 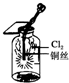 如图:产生了棕黄色的雾 | |
| D. | 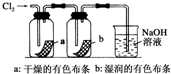 如图:湿润的有色布条褪色,说明氯气具有漂白性 |
(1)S位于元素周期表第三周期第VIA族;Fe的基态原子最外层有2个电子.
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| N>O | O2->Al3+ | KCl>硫黄 | H2SO4<HClO4 |
(4)向KAlO2溶液中不断通入NO2气体,反应的现象为先生成白色沉淀,然后白色沉淀不断溶解,其中涉及氧化还原反应的离子方程式为3NO2+H2O═2H++2NO3-+NO,此反应的氧化剂与还原剂的物质的量之比为1:2.
CO(g)+H2O(g)?CO2+H2(g)
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
| 物质 | A | B | C | D |
| 反应前质量/g | 4 | 6 | 111 | 4 |
| 反应后质量/g | 待测 | 15 | 0 | 84 |
| A. | 密闭容器中发生的化学反应属于分解反应 | |
| B. | 密闭容器中发生的化学反应属于化合反应 | |
| C. | 反应后密闭容器中A的质量为22g | |
| D. | 该反应中A.B、C、D四种物质的质量比为 26:9:111:80 |
 燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.Ⅰ.CH4还原法:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=bkJ•mol-1甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=0.5(a+b)kJ/mol.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
(2)T1< T2(填<,=,>); a<0(填<,=,>)
(3)在T1时,0~10min内内NO2的转化率是50%;欲提高NO2的转化率同时加快反应速率,可采取的措施有B
A.缩小容器体积 B.增大CH4浓度 C.降低温度 D.加入催化剂
Ⅱ. NOx也可以用NH3还原除去,利用反应6NO2+8NH3$?_{加热}^{催化剂}$7N2+12H2O也可处理NO2.当氧化产物和还原产物的质量差为14g时,转移电子的物质的量为12mol.
| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |