题目内容
17. (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:2CO(g)+O2(g)═2CO2(g)△H=akJ•mol-1
N2(g)+O2(g)═2NO(g)△H=b kJ•mol-1
①反应2NO(g)+2CO(g)═2CO2(g)+N2(g)△H=a-bkJ•mol-1.
②可以利用反应:NO2+G$\stackrel{催化剂}{→}$N2+H2O+nX(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是ad(填写字母).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
当反应中转移1.2mol电子时,消耗NO26.72L(标准状况).
③用NaOH溶液吸收工业尾气中的SO2最终制得石膏(CaSO4.2H2O).为节约资源减少排放实现物质的循环利用,生产过程中还需要加入的固体物质是CaO或Ca(OH)2(填化学式).
(2)工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示.则a极为阳极,该极的电极反应式NH4++3F--6e-=NF3+4H+.
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法.
分析 (1)①2CO(g)+O2(g═2CO2(g)△H1=akJ.mol-1 (i),N2(G)+O2(G)═2NO(g)△H2=bkJ.mol-1 (ii),(i)-(ii)得出目标方程式;
②根据氧化还原反应中氧化剂和还原剂的特点结合常见的氧化剂和还原剂来回答;
③石膏中含有元素Ca,结合反应原理判断固体物质即可;
(2)NH4+被氧化生成NF3气体,则a为阳极,b为阴极,
(3)用电镀法在铁板表面镀锌或锡可隔绝空气而防腐;
解答 解:①2CO(g)+O2(g═2CO2(g)△H1=akJ.mol-1 (i),N2(G)+O2(G)═2NO(g)△H2=bkJ.mol-1 (ii),(i)-(ii)得出目标方程式为:2NO(g)+2CO(g)?N2(g)+2CO2(g),故△H=(a-b)kJ.mol-1,
故答案为:a-b;
②将NO2变成无害的N2中,氮元素的化合价降低了,二氧化氮做氧化剂,需要加入还原剂,X必须为无污染的物质,在下列四种物质:a.NH3 b.CO2 c.SO2 d.CH3CH2OH中,能被二氧化氮氧化具有还原性的物质有乙醇和NH3,NO2由+4价降低为0价,降低4价,即转移4mol电子,当反应中转移1.2mol电子时,消耗NO2 为0.3mol,体积为6.72L,
故答案为:ad;6.72;
③二氧化硫为酸性气体,除利用氢氧化钠浓溶液吸收外,还可以利用CaO或氢氧化钙吸收制取石膏,故还需要的固体物质是CaO或Ca(OH)2,
故答案为:CaO或Ca(OH)2;
(2)由图可知,NH4+被氧化生成NF3气体,则a为阳极,b为阴极,阳极上铵根失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,
故答案为:阳;NH4++3F--6e-=NF3+4H+;
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法,
故答案为:覆盖保护层.
点评 本题主要考查的是盖斯定律的应用、氧化还原反应方程式书写、电解池反应原理等,综合性较强,难度较大,注意整理归纳

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 纤维素被人体消化吸收后提供营养物质 | |
| B. | 能发生水解反应的不一定是糖类,但糖类一定能发生水解反应 | |
| C. | 没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液 | |
| D. | 1 mol二糖完全水解一定能够生成2 mol葡萄糖 |
| A. | 硝酸钾溶于水 | |
| B. | 氨气和氯化氢反应生成氯化铵晶体 | |
| C. | 水蒸气凝结为液态的水 | |
| D. | (NH4)2CO3分解生成二氧化碳、氨气和水 |
| A. | 10mL 0.5mol•L-1 CH3COONa 与6mL 1mol•L-1 盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl) |
| A. | 正、逆反应不再进行 | B. | 反应物的浓度为零 | ||
| C. | 反应物的浓度与生成物的浓度相等 | D. | 正、逆反应的速率相等 |
| A. |  如图:若浓盐酸过量,则理论上MnO2可全部消耗完 | |
| B. |  如图:证明新制氯水只具有酸性 | |
| C. | 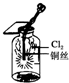 如图:产生了棕黄色的雾 | |
| D. | 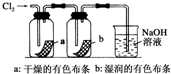 如图:湿润的有色布条褪色,说明氯气具有漂白性 |
(1)S位于元素周期表第三周期第VIA族;Fe的基态原子最外层有2个电子.
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| N>O | O2->Al3+ | KCl>硫黄 | H2SO4<HClO4 |
(4)向KAlO2溶液中不断通入NO2气体,反应的现象为先生成白色沉淀,然后白色沉淀不断溶解,其中涉及氧化还原反应的离子方程式为3NO2+H2O═2H++2NO3-+NO,此反应的氧化剂与还原剂的物质的量之比为1:2.
 燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.Ⅰ.CH4还原法:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=bkJ•mol-1甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=0.5(a+b)kJ/mol.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
(2)T1< T2(填<,=,>); a<0(填<,=,>)
(3)在T1时,0~10min内内NO2的转化率是50%;欲提高NO2的转化率同时加快反应速率,可采取的措施有B
A.缩小容器体积 B.增大CH4浓度 C.降低温度 D.加入催化剂
Ⅱ. NOx也可以用NH3还原除去,利用反应6NO2+8NH3$?_{加热}^{催化剂}$7N2+12H2O也可处理NO2.当氧化产物和还原产物的质量差为14g时,转移电子的物质的量为12mol.
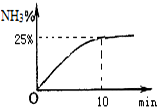 目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.