题目内容
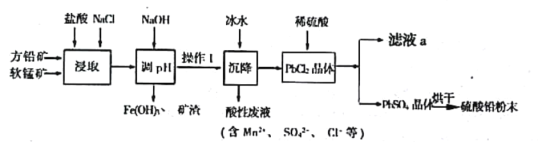
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
已知:
i.PbCl2 难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
iii.Ksp(PbSO4) =1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS 发生反应生成PbCl2和S的化学方程式为___________________;
(2)沉降操作时加入冰水的作用是____________________________;
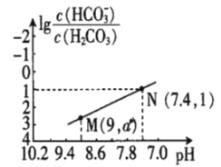
(3)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是___________(填字母)
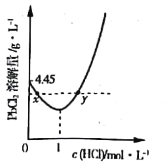
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+) 不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随HCl浓度增大,PbCl2 溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是_________________________________,操作I的方法是____________________;PbCl2“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c(SO42-)=_________________________;
(5)滤液a经过处理后可以返回到__________________工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂—三盐基硫酸(3PbO·PbSO4·H2O),写出该反应的反应方程式________________________。
【答案】MnO2+PbS+4HCl=PbCl2+S+MnCl2 +2H2O PbCl2难溶于冷水,降低PbCl2的溶解度,便于析出PbCl2晶体 BD 使Fe3+沉淀而除去 过滤 6.75×10-6 浸取 4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O
【解析】
方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)中加入稀盐酸,根据酸性废液中的成分可知该过程中PbS中部分S元素被氧化成硫酸根离子,MnO2被还原成Mn2+,加入的NaCl可促进反应PbCl2(s)+2Cl-(aq)PbCl42-(aq)平衡正向移动使更多的Pb元素存在于溶液中,加入NaOH溶液调节溶液pH,使铁离子转化成氢氧化铁沉淀,过滤得到氢氧化铁、矿渣和滤液;PbCl2难溶于冷水,将滤液液冷水沉降过滤得到PbCl2晶体,之后加入稀硫酸发生沉淀转化,生成硫酸铅晶体,过滤得到晶体烘干得到硫酸铅粉末,滤液a中主要成分为HCl。
(1)根据题意可知该过程中MnO2将PbS2中的S元素氧化成S单质,锰元素被还原成Mn2+,根据电子守恒和元素守恒可得方程式为MnO2+PbS+4HCl=PbCl2+S+MnCl2 +2H2O;
(2)根据题目信息可知氯化铅难溶于冷水,加入冰水可降低PbCl2的溶解度,便于析出PbCl2晶体;
(3)PbCl2是微溶化合物,溶于水存在下列平衡:PbCl2(s)Pb2+(aq)+2Cl-(aq),由图象可知在浓度为1mol/L时溶解量最小,小于1mol/L时,主要是电离出的氯离子抑制氯化铅的溶解,大于1mol/L时,可发生络合反应:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),而促进溶解。
PbCl42-(aq),而促进溶解。
A.Ksp(PbCl2)只受温度的影响,温度不变,则Ksp(PbCl2)不变,故A错误;
B.根据分析可知x、y两点对应的溶液中的溶质不同,所以c(Pb2+)不相等,故B正确;
C.根据分析可知当盐酸浓度大于1mol/L时,可发生反应:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
D.根据分析可知盐酸浓度小于1mol·L-1时,主要存在平衡PbCl2(s)Pb2+(aq)+2Cl-(aq),氯离子的增多使平衡逆向移动,故D正确;
综上所述选BD;
(4)溶液中有杂质铁离子,调pH值可使Fe3+沉淀而除去;分离固体和液体的操作为过滤;沉淀转化的方程式为PbCl2(s)+SO42-(aq)PbSO4(s)+2Cl-(aq),该反应的平衡常数K=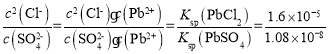 ,所以当c(Cl-)=0.100mol/L时,c(SO42-)=
,所以当c(Cl-)=0.100mol/L时,c(SO42-)=![]() 6.75×10-6mol/L;
6.75×10-6mol/L;
(5)滤液a中的主要溶质为HCl,所以经处理后可以返回到浸取工序循环使用;反应物有PbSO4和NaOH,生成中有3PbO·PbSO4·H2O ,根据元素化合价的变化可知该反应不是氧化还原反应,所有根据元素守恒可得方程式:4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
B | 向酸性KMnO4 溶液中滴加乙醇 | 溶液褪色 | 乙醇具有还原性 |
C | 向溴水中加入苯,充分振荡、静 置 | 水层几乎无色 | 苯与溴发生了反应 |
D | 向FeCl3和BaCl2 的混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,白色沉淀为BaSO3 |
A.AB.BC.CD.D