题目内容
【题目】亚硝酰氨(NOCl)是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点-64.5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)将5g经300℃下干燥了3h并研细的KCl粉末装 50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0.002molNO2。反应12~36min即可完成,NO2红棕色消失,出现黄色亚硝酰氯,同时还得到一种盐,该盐的化学式为_____________,氯化钾需要“干燥”的原因是_____________________________。
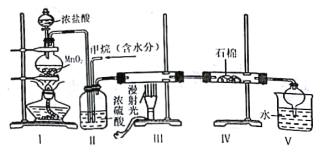
(2)实验室可由氯气与一氧化氮在常温常压下合成亚硝酰氯,装置如图所示:
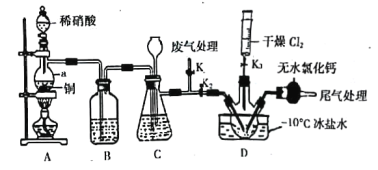
①仪器a的名称为____________________________;
②B装置的作用是____________________________;
③实验开始时,先打开K1,关闭K2、K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________________时,打开K3向装置D三颈瓶中推入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再关闭K1、K3,打开K2制备NOCl。
(3)测定产品纯度:取(2)中w g D中液态产品溶于蒸馏水,配制成250 mL溶液;用酸式滴定管准确量取25.00 mL所配制溶液于锥形瓶中,滴加几滴K2CrO4溶液作指示剂,用滴定管盛装c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。(已知:Ag2CrO4为砖红色固体,忽略杂质参与反应)
①盛装AgNO3标准溶液的滴定管是_____________(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________。
②该产品纯度为_____________(用代数式表示)。
【答案】KNO3 NOCl遇水易水解,NO2与水反应 蒸馏烧瓶 除去NO中的NO2 红棕色气体完全消失 酸式 溶液中恰好出现砖红色沉淀且半分钟内不消失 ![]()
【解析】
实验开始时,先打开K1、K2,关闭K3,打开分液漏斗活塞滴入适量稀硝酸,和铜反应生成NO,由于装置中有空气,所以生成的NO会被氧化成红棕色的NO2,通过装置B中水除去挥发的硝酸及NO和空气中氧气反应生成的二氧化氮,此时装置C的作用为储存A中产生的NO气体,同时长颈漏斗插入液面以下可以防止体系内压强过高,因为C中也有空气,所以C中也会先生成NO2,至C中红棕色完全消失后,再打开K3,向D装置中通入干燥纯净的Cl2,当D中充满黄绿色气体时,再关闭K1、K3,打开K2制备NOCl;装有无水CaCl2的干燥管其作用为防止水蒸气进入D中,防止NOC1水解;该滴定原理是通过硝酸银标准液来滴定产品中的Cl元素的量来确定产品的量,滴定过程中先发生Cl-+Ag+=AgCl↓,当氯离子全部沉淀后银离子和K2CrO4反应生成Ag2CrO4,溶液会出现砖红色沉淀。
(1)NO2中N的化合价为+4,NO2与KCl反应生成的NOCl中N的化合价为+3价,化合价降低,根据氧化还原反应规律,需要有元素化合价升高,根据元素价态变化规律可知该反应中N元素发生歧化,即化合价既升高又降低,可以判断盐为硝酸钾,化学式为KNO3;根据题目信息,干燥的目的是防止生成的氯化亚硝酰遇水反应,降低产率,且防止NO2与水反应;
(2)①根据a的结构特点可知其为分液漏斗;
②根据分析可知装置B的主要作用是除去NO中混有的NO2;
③根据分析可知需要观察到C中红棕色气体完全消失时再进行下一步操作;
(3)①硝酸银溶液由于银离子的水解会显酸性,且见光易分解,所以需要用酸式棕色滴定管;根据分析可知滴定终点现象为:溶液中恰好出现砖红色沉淀且半分钟内不消失;
②根据发生的反应可知存在数量关系NOCl~Cl-~AgNO3,则n(NOCl)=n(AgNO3)=cV×10-3mol,所以产品的纯度为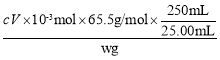 ×100%=
×100%=![]()