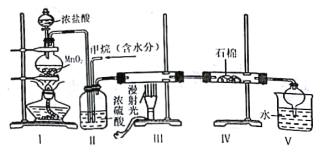
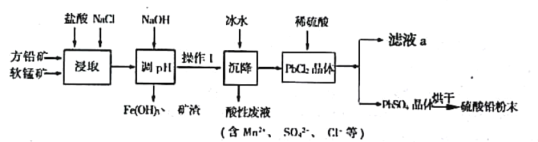
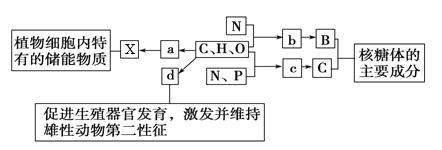
题目内容
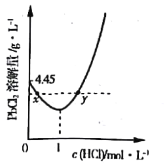
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
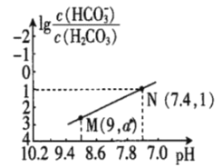
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
【答案】D
【解析】
A.25℃时,在N点,pH=7.4,则c(H+)=10-7.4,lg![]() =1,则
=1,则![]() =10, H2CO3的一级电离K(H2CO3)=
=10, H2CO3的一级电离K(H2CO3)=![]() =10-7.4×10=1.0×10-6.4,A正确;
=10-7.4×10=1.0×10-6.4,A正确;
B.图中M点,pH=9,c(H+)=10-9,K(H2CO3)=![]() =1.0×10-6.4,
=1.0×10-6.4,![]() =102.6,a= lg
=102.6,a= lg![]() =2.6,B正确;
=2.6,B正确;
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=
H2CO3+OH-的Kh= ![]() =
=![]() =1.0×10-7.6,C正确;
=1.0×10-7.6,C正确;
D.M点溶液中:依据电荷守恒,c(H+)+c(Na+)=c(Cl-)+2c(CO32-)+c(OH-)+ c(HCO3-),此时溶液为NaHCO3、NaCl的混合溶液,则c(Na+)>c(H2CO3) + c(HCO3-),所以c(H+)+c(H2CO3)<c(Cl-)+2c(CO32-)+c(OH-),D错误;
故选D。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目