题目内容
5.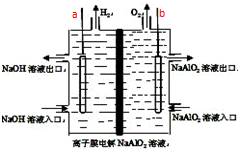 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )| A. | 当有0.1mol 电子发生转移时,a极产生气体在标准状况下为112mL | |
| B. | 该电池使用时应选择阴离子交换膜 | |
| C. | 电池工作结束后,左右两侧电解槽均会有Al(OH)3沉淀生成 | |
| D. | 该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑ |
分析 A、根据图示知道A电极是阴极,电极反应为:2H++2e-=H2↑,根据电极反应式计算即可;
B、在阴极上减少氢离子,氢氧根离子浓度增加,为在阴极获得氢氧化铝,应该让铝离子移向阴极;
C、在阴极上减少氢离子,氢氧根离子浓度增加,铝离子移向阴极,在该极上可以获得氢氧化铝;
D、根据原理电解偏铝酸钠制取氢氧化铝结合两极上的反应来判断回答.
解答 解:A、A、根据图示a电极上产生氢气知道,a电极是阴极,电极反应为:2H++2e-=H2↑,当有0.1mol 电子发生转移时,a极产生气体为0.05mol,在标准状况下为112mL,故A错误;
B、在阴极上减少氢离子,氢氧根离子浓度增加,为在阴极获得氢氧化铝,应该让铝离子移向阴极,所以该电池使用时应选择阳离子交换膜,让铝离子通过,故B错误;
C、在阴极上减少氢离子,氢氧根离子浓度增加,铝离子移向阴极,在该极上可以获得氢氧化铝,即电池工作结束后,左侧电解槽均会有Al(OH)3沉淀生成,故C错误;
D、电解偏铝酸钠制取氢氧化铝时,阳极上生成氧气,阴极上产生氢气和氢氧化铝,电解方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑,故D正确.
故选D.
点评 本题考查学生电解池的工作原理以及电极反应式的书写和计算等知识,属于综合知识的考查,较综合,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.能证明丙烯分子里含有一个碳碳双键的事实是( )
| A. | 丙烯分子里碳氢原子个数比为1:2 | |
| B. | 丙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 丙烯容易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质 | |
| D. | 丙烯能使酸性KMnO4溶液褪色 |
20.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 硝酸铵溶于水使温度降低 | D. | 氧化钙溶于水 |
10.通常海水的pH=8.1,在稳定海水pH中起作用的离子是( )
| A. | Na+ | B. | HCO3- | C. | CO32- | D. | Cl- |
15.在大多数有机物分子里,碳原子和碳原子、碳原子和其他原子间相结合的化学键是( )
| A. | 既是离子键、又有非极性共价键 | |
| B. | 既有极性共价键,又有非极性共价键 | |
| C. | 都是非极性共价 | |
| D. | 都是极性共价键 |


 ,写出正确的合成路线:
,写出正确的合成路线: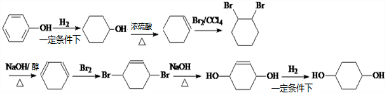 .
.

