题目内容
10.通常海水的pH=8.1,在稳定海水pH中起作用的离子是( )| A. | Na+ | B. | HCO3- | C. | CO32- | D. | Cl- |
分析 通常海水的pH=8.1,可知海水呈弱碱性,根据选项中各离子的性质来分析即可.
解答 解:通常海水的pH=8.1,比较固定,即海水中存在某些离子对海水的H+、OH-的浓度改变起到缓冲作用.
A、Na+既不能水解液不能电离,与H+、OH-均不反应,对海水溶液的pH起不到缓冲作用,故A不选;
B、HCO3-既能与H+反应又能和OH-反应,故HCO3-的存在能对海水溶液中的pH的变化起到缓冲作用,能稳定海水的pH,故B选;
C、CO32-只能和H+反应,与OH-不反应,故不能对海水的pH起到缓冲作用,故C不选;
D、Cl-既不能水解液不能电离,与H+、OH-均不反应,对海水溶液的pH起不到缓冲作用,故D不选.
故选B.
点评 本题考查了离子的性质,应注意的是HCO3-既能与H+反应又能和OH-反应,故当HCO3-存在时,溶液的pH变化不会很明显,能起到稳定溶液的pH的作用.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
20.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在25℃,1.01×105Pa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量等于57.3 kJ |
18.下列对于铯(Cs)的性质的预测中,正确的是( )
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
5.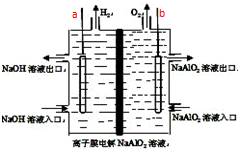 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )| A. | 当有0.1mol 电子发生转移时,a极产生气体在标准状况下为112mL | |
| B. | 该电池使用时应选择阴离子交换膜 | |
| C. | 电池工作结束后,左右两侧电解槽均会有Al(OH)3沉淀生成 | |
| D. | 该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑ |
15.为了检验某溴代烃中的溴元素,现进行如下操作,其中合理的是( )
| A. | 取溴代烃少许,加入AgNO3溶液 | |
| B. | 取溴代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取溴代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 | |
| D. | 取溴代烃少许与NaOH水溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 |
2.下列各物质中,按熔点由低到高排列正确的是( )
| A. | O2、I2、Hg | B. | 铝硅合金、铝、金刚石 | ||
| C. | Na、K、Rb | D. | SiC、金属钠、SO2 |
20.只用一种试剂就可以鉴别甲苯、乙醇、苯酚溶液、己烯是( )
| A. | 四氯化碳 | B. | 浓溴水 | C. | 溴的四氯化碳 | D. | 氯化铁溶液 |
 As
As