题目内容
13.能证明丙烯分子里含有一个碳碳双键的事实是( )| A. | 丙烯分子里碳氢原子个数比为1:2 | |
| B. | 丙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 丙烯容易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质 | |
| D. | 丙烯能使酸性KMnO4溶液褪色 |
分析 丙烯分子式为C3H6,与环丙烷互为同分异构体,如含有碳碳双键,可与溴水发生加成反应,可通过消耗的溴的量的关系判断是否含有碳碳双键,如含有碳碳双键,可发生加成反应和氧化反应,以此解答该题.
解答 解:A.分子里碳、氢原子个数比为1:2不能说明含有碳碳双键,如环丙烷,故A错误;
B.丙烯完全燃烧生成的CO2和H2O的物质的量相等只能说明其碳、氢原子个数之比,不能说明含有碳碳双键,故B错误;
C.丙烯与溴发生加成反应时,丙烯和溴的物质的量之比等于反应的计量数之比,所以能证明含有一个碳碳双键,故C正确;
D.能使酸性高锰酸钾溶液褪色的不一定是碳碳双键,碳碳三键也能使酸性高锰酸钾溶液褪色,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握实验证明的角度和合理性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.从分类角度看,下列说法正确的是( )
| A. | 胶体与其他分散系的本质区别是丁达尔效应 | |
| B. | 氨气属于非电解质,Cu属于电解质 | |
| C. | Na2CO3溶液显碱性,说明Na2CO3属于碱 | |
| D. | 二氧化碳和二氧化硫都是酸性氧化物 |
4.下列关于卤化氢的说法不正确的是( )
| A. | 卤素原子半径越大,氢化物越稳定 | |
| B. | 卤素原子半径越大,氢化物越不稳定 | |
| C. | 卤素氢化物稳定性:HF>HCl>HBr>HI | |
| D. | 卤族单质与氢气越难反应,生成的氢化物越不稳定 |
8.将足量的氯气通入下列溶液中,溶质阴、阳离子的数目都明显改变的是( )
| A. | AgNO3 | B. | FeBr2 | C. | NaOH | D. | Na2CO3 |
18.下列对于铯(Cs)的性质的预测中,正确的是( )
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
5.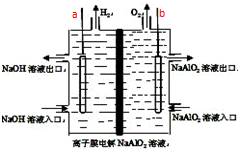 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )| A. | 当有0.1mol 电子发生转移时,a极产生气体在标准状况下为112mL | |
| B. | 该电池使用时应选择阴离子交换膜 | |
| C. | 电池工作结束后,左右两侧电解槽均会有Al(OH)3沉淀生成 | |
| D. | 该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑ |
2.下列各物质中,按熔点由低到高排列正确的是( )
| A. | O2、I2、Hg | B. | 铝硅合金、铝、金刚石 | ||
| C. | Na、K、Rb | D. | SiC、金属钠、SO2 |
3.下列各反应属于加成反应的是( )
| A. | CH4+2O2→CO2+2H2O | B. | 2CH3CH2OH+O2→2CH3CHO+2H2O | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | CH2=CH2+Br2→CH2Br-CH2Br |
 As
As