题目内容
7.下列溶液中粒子的物质的量浓度关系正确的是( )| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(C${{O}_{3}}^{2-}$)>c(HC${{O}_{3}}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(N${{H}_{4}}^{+}$)>c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.反应后的溶液中溶质为碳酸钠,碳酸根离子部分水解,溶液显示碱性,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(HCO3-)<c(OH-);
B.二者反应后溶质为等浓度的醋酸钠和醋酸,混合液显示酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(Cl-)>c(CH3COOH);
C.氨水为弱碱,混合液中氨水过量,溶液显示碱性,则c(OH-)>c(H+);
D.二者恰好反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性,根据醋酸钠溶液中的质子守恒判断.
解答 解:A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,二者恰好反应才碳酸钠,碳酸根离子部分水解,溶液显示碱性,且氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-),故所得溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故A错误;
B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合,反应后溶质为等浓度的醋酸和醋酸钠,混合液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒可得:c(CH3COO-)>c(Cl-)>c(CH3COOH),所得溶液中离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B正确;
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,氨水为弱碱,则混合液呈碱性:c(OH-)>c(H+),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,二者恰好反应生成醋酸钠,根据醋酸钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成及盐的水解原理为解答关键,要求学生能够根据电荷守恒、物料守恒及质子守恒判断溶液中各离子浓度大小.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | KAl(SO4)2溶液:c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| B. | 用酚酞作指示剂,向氨水中滴入标准盐酸至滴定终点:c(NH4+)<c(Cl-) | |
| C. | NH4Cl与Ba(NO3)2的混合溶液:c(Cl-)+2c(NO3-)=c(NH4+)+c(NH3•H2O)+c(Ba2+) | |
| D. | 饱和氯水中:c(H+)=2c(ClO-)+c(HClO)+c(OH-) |
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若使用氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 一定浓度的双氧水可用于伤口的消毒 |
| A. | SO2 | B. | NaHSO3 | C. | CH3COONa | D. | FeCl2 |
| A. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| B. | 钠具有很强的还原性,可用钠与TiCl4反应制取钛 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | 铜的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀 |
| A. | 按系统命名法,有机物 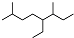 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 谷氨酸分子(α-氨基戊二酸)缩合只能形成1种二肽(不考虑立体异构) | |
| D. | 在一定条件下,1.0 mol的 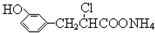 最多能与含3.0 mol NaOH的溶液完全反应 最多能与含3.0 mol NaOH的溶液完全反应 |

| A. | 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| B. | 途径②增大O2浓度可提高SO2转化率 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1)+O2 (g)为放热反应 |
 ”结构存在的同分异构体的数目有( )
”结构存在的同分异构体的数目有( )