题目内容
3.中学化学中很多“规律”都可以类推,下列根据有关“规律”推出的结论正确的是( )| A. | 硅是半导体材料,故同族的锗也是半导体材料 | |
| B. | 浓硫酸可以干燥HCl气体,故也可用浓硫酸干燥HI气体 | |
| C. | Na在空气中燃烧会生成Na2O2,故Li在空气中燃烧也会生成Li2O2 | |
| D. | 卤族元素单质随核电荷数增加熔点升高,故碱金属单质熔点也随核电荷数增加而升高 |
分析 A、同族元素具有相似性;
B、碘化氢具有强还原性;
C、Li在空气中燃烧只生成Li2O;
D、同主族随原子序数增大,金属原子的半径增大,金属键减弱,熔点降低.
解答 解:A、同族元素具有相似性,锗也是半导体材料,故A正确;
B、碘化氢具有强还原性,与浓硫酸发生氧化还原反应,所以浓硫酸不能干燥HI气体,故B错误;
C、Li在空气中燃烧只生成Li2O,不能生成Li2O2,故C错误;
D、同主族随原子序数增大,金属原子的半径增大,金属键减弱,熔点降低,所以碱金属单质熔点随核电荷数增加而降低,故D错误.
故选A.
点评 本题综合考查元素化合物知识,侧重于基础知识的考查,注意常见的干燥剂的使用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列各组化合物的水溶液中,碱的碱性减弱,酸的酸性增强的是( )
| A. | NaOH,LiOH,HNO3,H3PO4 | B. | Mg(OH)2,Al(OH)3,HBrO4,HClO4 | ||
| C. | Mg(OH)2,Ca(OH)2,H3PO4,H2SO4 | D. | NaOH,Mg(OH)2,H3PO4,HClO4 |
14.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O$\stackrel{△}{→}$2C6H5OH+CO32- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
11.水杨酸环已酯具有花香气味,可作为香精配方.其合成路线如下:下列说法正确的是( )
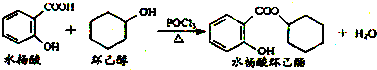
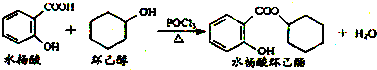
| A. | 水杨酸能分别与NaHCO3、Na2CO3溶液反应,且1 mol水杨酸分别消耗NaHCO32mol、Na2CO31mol | |
| B. | 水杨酸、环己醇和水杨酸环己酯均能与FeCl3溶液发生显色反应 | |
| C. | 1 mol水杨酸环己酯在NaOH溶液中水解时,最多消耗3 mol NaOH | |
| D. | 1 mol水杨酸跟足量浓溴水反应时,最多消耗Br2 2 mol |
18.下列离子方程式中正确的是( )
| A. | 少量SO2通入NaOH溶液中:OH-+SO2→HSO3- | |
| B. | H2S通入氯水中:S2-+Cl2→S↓+2Cl- | |
| C. | 二氧化氮溶于水:3NO2+H2O→2H++2NO3-+NO↑ | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O |
15.天然气是一种多组分的化石燃料.其主要成分是( )
| A. | 甲烷 | B. | 氮气 | C. | 氢气 | D. | 氧气 |
12.把纯碘化氢气体装入密闭容器中,它将按2HI?H2+I2反应进行分解(正反应吸热),当系统在趋向平衡状态的过程中,以下描述正确的是( )
| A. | 碘化氢的生成速率大于其分解速率 | |
| B. | 碘化氢的生成速率等于其分解速率 | |
| C. | 加催化剂不会影响达到平衡的时间 | |
| D. | 升高温度可以缩短到达平衡状态的时间 |
 H、C、O、N、S、Cl是常见的几种非金属元素.
H、C、O、N、S、Cl是常见的几种非金属元素. .
. CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式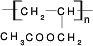 .
.