题目内容
18.下列离子方程式中正确的是( )| A. | 少量SO2通入NaOH溶液中:OH-+SO2→HSO3- | |
| B. | H2S通入氯水中:S2-+Cl2→S↓+2Cl- | |
| C. | 二氧化氮溶于水:3NO2+H2O→2H++2NO3-+NO↑ | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O |
分析 A.二氧化硫少量,反应生成亚硫酸根离子;
B.硫化氢为气体,离子方程式中不能拆开;
C.二氧化氮与水反应生成硝酸和一氧化氮气体;
D.氢氧化钡过量,离子方程式按照硫酸氢钠的化学式组成书写,氢离子和氢氧根离子的系数错误.
解答 解:A.少量SO2通入NaOH溶液中,反应生成亚硫酸钠和水,正确的离子方程式为:2OH-+SO2→H2O+SO32-,故A错误;
B.H2S通入氯水中,硫化氢不能拆开,正确的离子方程式为:H2S+Cl2→S↓+2H++2Cl-,故B错误;
C.二氧化氮溶于水,反应生成硝酸和一氧化氮,反应的离子方程式为:3NO2+H2O→2H++2NO3-+NO↑,故C正确;
D.少量NaHSO4与过量Ba(OH)2溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:H++SO42-+Ba2++OH-→BaSO4↓+H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等,D为易错点,注意反应物过量情况对生成物影响.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
8.能用分液漏斗进行分离的一组物质是( )
| A. | 苯和硝基苯 | B. | 丙酸甲酯和水 | C. | 乙酸乙酯和乙酸 | D. | 溴苯和溴 |
9.下列有关氯气的叙述中,正确的是( )
| A. | 工业上常用MnO2和浓盐酸共热来制取氯气 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 在氧化还原反应中,Cl2只能作氧化剂 | |
| D. | 若提供含0.4 mol HCl的浓盐酸,MnO2过量,则可制得标准状况下氯气2.24 L |
6.分子式为C5H9O2Cl,属于卤代酯且能发生银镜反应的同分异构体共有( )
| A. | 10种 | B. | 11种 | C. | 12种 | D. | 13种 |
13.下列属于氮的固定的是( )
| A. | N2和H2在Pt作用下反应生成NH3 | B. | NH4Cl和Ca(OH)2反应生成NH3 | ||
| C. | NO2和水制硝酸 | D. | 由NH3制氮肥 |
3.中学化学中很多“规律”都可以类推,下列根据有关“规律”推出的结论正确的是( )
| A. | 硅是半导体材料,故同族的锗也是半导体材料 | |
| B. | 浓硫酸可以干燥HCl气体,故也可用浓硫酸干燥HI气体 | |
| C. | Na在空气中燃烧会生成Na2O2,故Li在空气中燃烧也会生成Li2O2 | |
| D. | 卤族元素单质随核电荷数增加熔点升高,故碱金属单质熔点也随核电荷数增加而升高 |
10.下列实验装置所示的实验不能达到实验目的是( )
| A. | 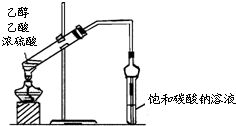 实验室制取乙酸乙酯 | B. | 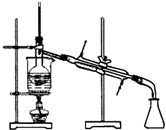 实验室蒸馏石油 | ||
| C. | 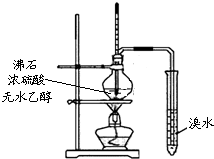 实验室制取乙烯并验证其性质 | D. | 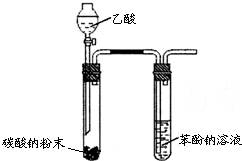 验证乙酸、碳酸、苯酚酸性强弱 |
7.下列物质进行一氯取代反应,产物只有两种的是( )
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
8.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| C. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| D. | 用酸性高锰酸钾溶液鉴别甲苯、环己烷和环己烯 |