题目内容
【题目】为探究SO2与Fe3+间是否发生氧化还原反应,按如图装置进行实验(夹持、加热仪器略),下列说法正确的是( )
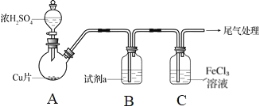
A.A中的反应仅体现了浓硫酸的氧化性
B.试剂a为饱和NaHCO3溶液
C.C中溶液pH降低,证明Fe3+氧化了SO2
D.检验C中的溶液含有Fe2+,证明Fe3+氧化了SO2
【答案】D
【解析】
A. 铜和浓硫酸反应生成硫酸铜和二氧化硫,该反应体现了浓硫酸的氧化性和酸性,故A错误;
B. 试剂a为饱和NaHSO3溶液,故B错误;
C. C中溶液pH降低,可能是SO2溶于水生成亚硫酸,故C错误;
D. 检验C中的溶液含有Fe2+,说明Fe3+降低变为Fe2+,因此证明Fe3+氧化了SO2,故D正确。
综上所述,答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________。
Ⅱ.上述反应适宜的温度范围是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________、_________和2Al + N2 ![]() 2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
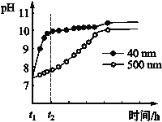
① AlN粉末水解的化学方程式是____________________________________。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________。