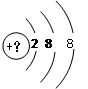题目内容
已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子。请填空:
(1)写出A、B、C、D对应的元素符号:A________、B________、C________、D________。
(2)写出工业生产中BD3与氧气反应的化学方程式:
________________________________________________________________________。
(3)你认为B、C、D元素形成的化合物之间________(填“能”或“不能”)发生下面的反应BC+BD3―→DBC2+D2C,得出上面结论的理由是__________________________ _。
(4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g)  4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
Ⅱ. 若维持温度不变,在一个与Ⅰ反应前的起始体积相同,容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a________b(填“>”“<”“=”或“不能确定”)。
(1)C N O H (2)4NH3+5O2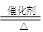 4NO+6H2O
4NO+6H2O
(3)不能 反应中只有N元素化合价的升高,而没有元素化合价的降低
(4)Ⅰ.80a% Ⅱ.>
解析试题分析:A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,所以A是碳元素,B是氮元素,C是氧元素。D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子,则D应该是氢元素。
(1)A、B、C、D对应的元素符号分别是C、N、O、H。
(2)氨气发生催化氧化的化学方程式是4NH3+5O2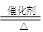 4NO+6H2O。
4NO+6H2O。
(3)在反应中只有N元素化合价的升高,而没有元素化合价的降低,不符合氧化还原反应的特点,因此该反应不能发生。
(4)Ⅰ.反应的化学方程式是
4CO+2NO2 4CO2+N2
4CO2+N2
起始量(mol) 1 1 0 0
转化量(mol) 2x x 2x 0.5x
平衡量(mol) 1-2x 1-x 2x 0.5x
则2x+0.5x=a
解得x=0.4mol
所以CO的转化率是80a%
Ⅱ.由于该反应是体积减小的可逆反应,则如果保持温度和容积不变,则压强是减小的。而压强低不有利于反应向正反应方向进行,所以a>b。
考点:考查元素的推断、氧化还原反应的有关判断、可逆反应的计算以及外界条件对平衡状态对影响
点评:该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生灵活运用基础知识解决实际问题的能力,有助于培养学生的逻辑推理能力和发散思维能力。该题的难点是判断a与b的相对大小。

下表给出了五种元素的相关信息,其中w、X、Y、Z为短周期元素,原子序数依次递增。
| 元素 | 相关信息 |
| W | 单质为密度最小的气体 |
| X | 元素最高正价与最低负价之和为0 |
| Y | 工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z | 存在质量数为23,中子数为12的核素 |
| T | 金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
根据上述信息填空:
(1)元素Y在元素周期表中的位置是 。XY2由固态变为气态所需克服的微粒间作用力是 。
(2)化合物甲是一种强氧化剂,由元素Y和Z组成,写出甲的化学式: ,
(3)化合物乙由元素W和X组成,乙是同时含极性共价键和非极性共价键的相对分子质量最小的分子。在25℃、101kpa下,已知2g的气体乙在Y2气体中完全燃烧后恢复至原状态,放热QkJ,该燃烧反应的热化学方程式是 。
(4)化合物丙仅由W、X、Y、Z、T中的四种元素组成,四种元素的质量比为1:6:40:64,化合物丙中含有两种阴离子,写出燃烧丙的化学方程式 。
下表为元素周期表的一部分。请回答下列问题:
根据元素在周期表中的相对位置可知①~⑩分别是H、C、N、O、Mg、Al、Cl、Ca、Mn、Fe。
(1)上述元素中,属于s区的是____________(填元素符号)。
(2)写出元素④的基态原子的价电子排布图____________________。
(3)元素第一电离能为⑨________⑩ (填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________________________。
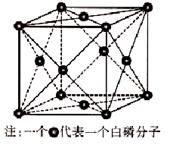
(5)⑥单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为 ,该晶体的密度为 (用字母表示)
(6)实验证明:⑤和⑧的氧化物、KCl、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: (用化学式填写)。
其中⑧的氧化物晶体中一个阳离子周围和它最邻近且等距离的阳离子有 个。