题目内容
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2, Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ;元素Z的离子结构示意图为 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为 。
(3)元素W位于周期表的第 族, 其非金属性比元素R弱,用原子结构的知识解释原
因 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂
与足量该氧化物反应的离子方程式 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在
高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为 。
(共11分)(1)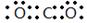 (1分)
(1分) 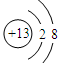 (1分)
(1分)
(2)8 HNO3(稀)+3 Cu=2NO↑+3Cu(NO3)2+4H2O(2分,写加热符号或不写“稀”不扣分)
(3)ⅤA(1分);P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱(2分,层数、
半径和能力答对两点给1分)
(4) SO2+NH3·H2O=HSO3-+NH4+(2分,反应物写成SO2+NH3+H2O不扣分)
(5) Al2O3+3 C+N2 2 AlN+3CO(2分)
2 AlN+3CO(2分)
解析试题分析:X原子核外各层电子数之比为1:2,则X应该是碳元素。Y的氧化物和R的氧化物均能形成酸雨,则两种元素是N和S。Y的原子序数小于R的,因此Y是N,R是S。W和R是同周期相邻元素,且W的原子序数小于R的,所以W是P元素。Y原子和Z原子的核外电子数之和为20,则Z的原子序数是20-7=13,因此Z是Al元素。
(1)碳元素是第ⅣA族元素,则元素C的最高价氧化物是CO2,CO2分子中含有碳氧双键,所以其电子式为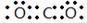 ;元素Al离子的核外电子数是10个,因此结构示意图为
;元素Al离子的核外电子数是10个,因此结构示意图为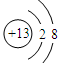 。
。
(2)元素N的最高价氧化物对应水化物的稀溶液是稀硝酸,具有强氧化性,能氧化单质铜,反应的离子方程式为8 HNO3(稀)+3 Cu=2NO↑+3Cu(NO3)2+4H2O。
(3)P元素的原子序数是15,位于周期表的第三周期第ⅤA族;P原子和S原子的电子层数相同,位于同一周期。同周期自左向右原子半径逐渐减小,即P原子半径较大,所以得电子能力较弱,非金属性弱于S元素的非金属性。
(4)R的一种氧化物能使品红溶液褪色,该氧化物是SO2。氮元素的氢化物是氨气,溶于水显碱性,因此足量SO2通入到氨水反应的离子方程式为SO2+NH3·H2O=HSO3-+NH4+。
(5)反应中氧化铝与碳单质的物质的量之比为1:3,则根据原子守恒可知,生成物AlN与碳的物质的量之比是2:3,因此碳与氮气的物质的量之比是3:1,这说明反应还有CO生成,因此反应的化学方程式为Al2O3+3 C+N2 2 AlN+3CO。
2 AlN+3CO。
考点:考查元素周期表的结构、元素周期律的应用;化学用语的书写等

J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等
| | | J | | |
| | | | | R |
M的气态原子逐个失去1~ 4个电子所需能量(电离能)如下表所示,
| | I1 | I2 | I3 | I4 | …… |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 | …… |
(1)M的电子排布式为________;元素T在周期表中的位置为________。
(2)J和氢能形成多种化合物,其中分子成直线型的,且相对分子质量最小的物质的结构式为________。
(3)M和T形成的化合物在潮湿的空气中冒白雾,反应的化学方程式为_________________。
(4)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为________。
(5)能源材料已成为当今科学研究的热点。氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是_______(填序号)。
a. C60、Si60、N60都属于新型化合物
b. C60、Si60、N60互为同分异构体
c. 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d. 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
下表是元素周期表的一部分,根据要求回答下列问题。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | | | | E | H | F | I | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | | |
(1)十种元素中化学性质最不活泼的元素是________(填元素符号)。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是________(填化学式)。
(3)I元素跟A元素形成化合物的电子式是________。高温灼烧该化合物时,火焰呈________色。
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是__________________。
元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式 ________________________。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: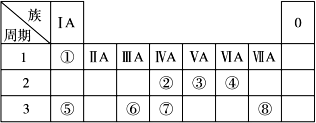
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
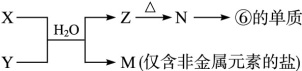
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
有关短周期元素A、B、C、D、E、F的信息如下:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |
请回答下列问题:
(1)写出实验室制取乙的化学方程式 。
(2)下列说法正确的是 (填序号)。
①实验室可用如图所示装置制取B的最高价氧化物

②用C单质做成的槽车,都可用来运输甲的浓溶液
③ C和铜与稀硫酸组成的原电池,C电极被还原
④ D单质在氧气中燃烧后的产物可用在防毒面具中作供氧剂
⑤鼓励乘坐公交车出行,倡导低碳生活,是控制和治理BO2解决“温室效应”的有效途径之一
 ⑥ DF的电子式为H∶Cl∶
⑥ DF的电子式为H∶Cl∶(3)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是 。
A.漂白剂 B.氧化剂 C.还原剂
(4)请用化学方法加以验证(3)中的氧化物,简要写出实验方法、试剂及预期可观察到的现象 。
 4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。