题目内容
【题目】NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________;原子核外最外层p亚层上电子自旋状态只有一种的元素是_____________。
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________(填化学符号);每摩尔铝粉可处理_____________gNaNO2。
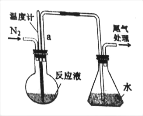
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________极;该装置中发生的化学方程式为_____________
(4)Na2SO3溶液中存在水解平衡![]() +H2O
+H2O![]()
![]() +
+![]() 设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
升温过程中PH减小的原因是_____________;①与④相比;C(![]() )①____________④(填“>”或“<”).
)①____________④(填“>”或“<”).
【答案】O N ![]() 34.5 正 2NaCl+2H2O
34.5 正 2NaCl+2H2O![]() 2NaOH+H2
2NaOH+H2![]() +Cl2
+Cl2![]() ,Cl2+2NaOH→NaCl+NaClO+H2 向溶液中滴加酚酞,发现变红 温度升高,Kw 变大,c(H+)增大,pH 变小(Na2SO3被氧化) >
,Cl2+2NaOH→NaCl+NaClO+H2 向溶液中滴加酚酞,发现变红 温度升高,Kw 变大,c(H+)增大,pH 变小(Na2SO3被氧化) >
【解析】
(1)电子层数越少,半径越小,电子层数相同,质子数越多半径越小;p亚层的电子数![]() ,p亚层上电子自旋状态只有一种;根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同;
,p亚层上电子自旋状态只有一种;根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同;
(2)铝在碱性条件下,生成偏铝酸盐;铝粉除去工业废水中的NaNO2,处理过程中产生氨气,反应方程式是![]() ;
;
(3)氯气与氢氧化钠反应生成次氯酸钠,为使氯气与氢氧化钠充分反应,a极应生成氯气;
(4)由于该水解平衡的存在,使Na2SO3溶液显碱性;水电离吸热,升高温度,水的电离平衡正向移动;①与④相比,温度相同,①的pH大于④,说明④中![]() 浓度减小。
浓度减小。
(1)上述三种盐所涉及的五种元素中,Na、Cl、S有3个电子层,半径较大,O、 N有2个电子层,且O的质子数大于N,所以半径较小的原子是O;根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同,所以p亚层上电子自旋状态只有一种的元素是N;
(2)铝在碱性条件下,生成偏铝酸盐,产物中铝元素的存在形式是![]() ;铝粉除去工业废水中的NaNO2,反应方程式是
;铝粉除去工业废水中的NaNO2,反应方程式是![]() ,根据方程式1molAl粉处理0.5mol NaNO2,质量是0.5mol×69g/mol=34.5g;
,根据方程式1molAl粉处理0.5mol NaNO2,质量是0.5mol×69g/mol=34.5g;
(3)a极氯离子失电子生成氯气,所以a极是阳极,应接在直流电源的正极;用石墨电极电解饱和食盐水生成氢氧化钠、氢气、氯气,氯气与氢氧化钠反应生成次氯酸钠,该装置中发生的化学方程式为2NaCl+2H2O![]() 2NaOH+H2
2NaOH+H2![]() +Cl2
+Cl2![]() ,Cl2+2NaOH=NaCl+NaClO+H2O;
,Cl2+2NaOH=NaCl+NaClO+H2O;
(4)该水解平衡的存在,Na2SO3使溶液显碱性,向溶液中滴加酚酞,发现变红,则证明该平衡的存在;水电离吸热,升高温度,水的电离平衡正向移动,Kw 变大,c(H+)增大,pH 变小; ①与④相比,温度相同,①的pH大于④,说明④中![]() 浓度减小,c (
浓度减小,c (![]() )①>④。
)①>④。

 阅读快车系列答案
阅读快车系列答案