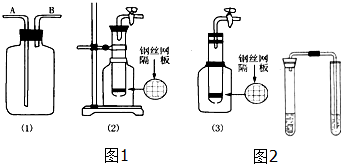
��Ŀ����
12��Na2S��H2O2�ڴӺ�����Ʒ������������⣬������CuZnFeCr�����ʣ�����ȡ����������ʱ����Ҫ���ã���ȡ�������£��ٵ�Ʒ������ù���������ữ�������õ���Һ��
������Һ�е���������Na2S��Һ����ȥCu2+ Zn2+��
�۱�����Һ��40�����ң���6%��H2O2��Һ����Fe2+������95��ʱ����NaOH��Һ���� pH�����˳�ȥ������
������Һ�м�������Na2CO3��Һ�����裬��NiCO3������
�ݡ�
��1��������г��ɹ۲쵽��ɫ�����⣬�����ᵽ��������ζ�������ӷ���ʽ˵������IJ�����S2-+2H +=H2S��
��2�����������Fe2+ �����Σ���Ҫ�����¶Ȳ�����40�棬��Ŀ���Ǽ��ٹ�������ķֽ⣻�ýη�����Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O��
��3��Fe2+ Ҳ������NaClO3������Fe2+���������ڽ�СpH������ˮ�⣬�����γɻ�������[Na2Fe6��SO4��4��OH��12]����������ȥ����֪25��ʱ��Fe��OH��3��Ksp=2.64��10 -39]������˵����ȷ����C������ĸ����
a��FeOOH����Ϊ+2��
b������25��ʱ����H2O2����Fe2+������pH=4ʱ��ȥ������ʱ��Һ��c��Fe3+ ��=2.64��10 -29 mol•L-1
c��������������������������Fe2+ �����ӷ���ʽΪ6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
��4����ˮNiCl2���л��ϳ������ż�Ϊ��Ҫ�����ã���ҵ�ϳ��ú���ԭ�����Ƶõ�NiCl2•6H2O���������ȣ�SOCl2���м�����ˮ�Ƶã���֪SOCl2����ˮ��Ӧ����SO2��HCl��д��NiCl2•6H2O���������ȣ�SOCl2���м�����ˮ����ˮNiCl2�ķ�Ӧ����ʽNiCl2•6H2O+6SOCl2$\frac{\underline{\;\;��\;\;}}{\;}$NiCl2+6SO2+12HCl��NiCl2•6H2O�����������ȣ�SOCl2���м�����ˮ��ԭ���ǣ�NiCl 2�ڼ��ȹ����лᷢ��ˮ����ò�����ˮNiCl 2����NiCl 2•6H2O���������ȣ�SOCl2���м�����ˮʱ����Ӧ�����в�����HCl������NiCl2��ˮ�⣮
���� ��1��ԭ��Һ�ữ���������ӣ�����2�м������ƺ��г�������ζ���������ɣ�����ΪH2S��
��2�������¶�40�棬�������������ӵ�ͬʱ��ֹ˫��ˮ�ֽ⣮˫��ˮ�����������ӣ�
��3��A�����ݻ��������ữ�ϼ۴�����Ϊ0���㣻
B��pH=4ʱ������������Ũ��Ϊ10-10mol/L������Fe��OH��3��Ksp=2.64��10 -39]������õ�Fe3+��Ũ�ȣ�
C��������������������������Fe2+ ��Ϊ�����ӣ���������ԭΪ�Ȼ��ƣ����ԭ���غ�͵���غ������
��4������������ˮ�ܷ�Ӧ���ɶ���������Ȼ��⣬�ʿ�������Ni2+ˮ�⣬����������ˮ�ܷ�Ӧ���ɵ��Ȼ���Ҳ������Ni2+ˮ�⣮
��� �⣺��1��ԭ��Һ�ữ���������ӣ�����2�м������ƺ��г�������ζ���������ɣ�����ΪH2S����Ӧ�����ӷ���ʽΪ��S2-+2H +=H2S����
�ʴ�Ϊ��S2-+2H +=H2S����
��2����Ҫ�����¶Ȳ�����40�棬��Ŀ�����������������ӵ�ͬʱ��ֹ˫��ˮ�ֽ⣮˫��ˮ�����������ӵķ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ʴ�Ϊ�����ٹ�������ķֽ⣻2Fe2++H2O2+2H+=2Fe3++2H2O��
��3��A�����ݻ��������ữ�ϼ۴�����Ϊ0���㣬FeOOH��Fe�Ļ��ϼ�Ϊ+3����A����
B��pH=4ʱ������������Ũ��Ϊ10-10mol/L������Fe��OH��3��Ksp=2.64��10 -39]������õ�Fe3+��Ũ��=$\frac{Ksp}{{c}^{3}��O{H}^{-}��}$=$\frac{2.64��1{0}^{-39}}{��1{0}^{-10}��^{3}}$=2.64��10-9mol/L����B����
C��������������������������Fe2+ ��Ϊ�����ӣ���������ԭΪ�Ȼ��ƣ����ԭ���غ�͵���غ���д�õ����ӷ���ʽΪ�����ӷ���ʽΪ6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O����C��ȷ��
�ʴ�Ϊ��C��
��4������������NiCl2•6H2O�����ڼ��ȹ�����NiCl2�ᷢ��ˮ����ò�����ˮNiCl2����NiCl2•6H2O���������ȣ�SOCl2���м�����ˮʱ����Ӧ�����в�����HCl������NiCl2��ˮ�⣬����������ˮ�ܷ�Ӧ���ɶ���������Ȼ��⣬�ʿ�������Ni2+ˮ�⣬NiCl2•6H2O���������ȣ�SOCl2���м�����ˮ����ˮNiCl2�ķ�Ӧ����ʽΪ��NiCl2•6H2O+6SOCl2$\frac{\underline{\;\;��\;\;}}{\;}$NiCl2+6SO2+12HCl��
�ʴ�Ϊ��NiCl2•6H2O+6SOCl2$\frac{\underline{\;\;��\;\;}}{\;}$NiCl2+6SO2+12HCl��NiCl 2�ڼ��ȹ����лᷢ��ˮ����ò�����ˮNiCl2����NiCl 2•6H2O���������ȣ�SOCl2���м�����ˮʱ����Ӧ�����в�����HCl������NiCl2��ˮ�⣮
���� ���⿼�����ʷ�����ᴿ�ķ��������̷����жϣ����ӷ���ʽ�ͻ�ѧ����ʽ��д����Ҫ��ʵ����ƺ��������ʵ�����Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�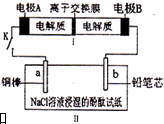 ��ͼ��ʾװ����һ�ֿɳ���أ�װ��IIΪ���أ����ӽ���Ĥֻ����Na+ͨ������ŵ�Ļ�ѧ����ʽΪ2Na2S2+NaBr3$?_{���}^{�ŵ�}$Na2S4+3NaBr���պϿ���Kʱ��b�������ȱ��ɫ������˵����ȷ���ǣ�������
��ͼ��ʾװ����һ�ֿɳ���أ�װ��IIΪ���أ����ӽ���Ĥֻ����Na+ͨ������ŵ�Ļ�ѧ����ʽΪ2Na2S2+NaBr3$?_{���}^{�ŵ�}$Na2S4+3NaBr���պϿ���Kʱ��b�������ȱ��ɫ������˵����ȷ���ǣ�������| A�� | ������ӦΪ2S22--2e-=S42- | |
| B�� | ����0.01 mol Na+ͨ�����ӽ���Ĥʱ��b�缫����������112 mL | |
| C�� | �պ�K��b�缫������pH��С | |
| D�� | �պ�K��a�缫����������� |
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ����25�棩 | K=1.77��10-4 | K=4.9��10-10 | K1=4.3��10-7��K2=5.6��10-11 |
| A�� | ��NaHCO3��Һ�У�c��OH-��-c��H+��=c��H2CO3��-c��CO32-�� | |
| B�� | ��NaCN��Һ��ͨ������CO2�����ӷ���ʽ��2CN-+H2O+CO2=2HCN+CO32- | |
| C�� | �к͵��������pH��HCOOH��HCN����NaOH����ǰ�ߴ��ں��� | |
| D�� | �����ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH��NaHCO3����pH��NaCN����pH��HCOONa�� |
| A�� | 0.1 mol/L Na2SO3��Һ��c��Na+��=2c��SO32-��+c��HSO3-��+c��H2SO3�� | |
| B�� | 0.1 mol•L-1 NaHCO3��Һ�У�c��Na+����c��HCO3-����c��CO32-����c��H2CO3�� | |
| C�� | �Ե��з�̪��CH3COONa��Һ���м��ȣ���Һ��ɫ����� | |
| D�� | ��pH=5.6��CH3COOH��CH3COONa�Ļ����Һ�У�c��Na+����c��CH3COO-�� |
| A | B | C | D | E | G | |
| ��ͻ��ϼ� | -4 | -2 | -1 | -2 | -1 | -3 |
| �縺�� | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
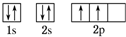 Cԭ�ӵļ۵����Ų�ʽ3s23p5
Cԭ�ӵļ۵����Ų�ʽ3s23p5��2��A��B��C��G��Ӧ������������ˮ����������ǿ����HClO4��д��ѧʽ����
��3����ͬ�����£�AD2��BD2������ˮ�е��ܽ�Ƚϴ����SO2��д��ѧʽ����������CO2�ǷǼ��Է��ӣ�SO2��H2O���Ǽ��Է��ӣ����ݡ��������ܡ���SO2��H2O�е��ܽ�Ƚϴ�
��4��A��B��D�γɵ��⻯��е㣺H2O���ߣ����ȶ���H2O��ǿ����д��ѧʽ��
��5�����ݵȵ���ԭ������ѧͨʽ��ͬ�Ҽ۵���������ȵķ��ӻ����ӣ��ṹ���ƣ���д��AD���ӵĽṹʽC��O��
��6����֪AG-��G2�ṹ���ƣ�����HAG�����ЦҼ���м���Ŀ֮��Ϊ1��1��