��Ŀ����
3��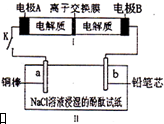 ��ͼ��ʾװ����һ�ֿɳ���أ�װ��IIΪ���أ����ӽ���Ĥֻ����Na+ͨ������ŵ�Ļ�ѧ����ʽΪ2Na2S2+NaBr3$?_{���}^{�ŵ�}$Na2S4+3NaBr���պϿ���Kʱ��b�������ȱ��ɫ������˵����ȷ���ǣ�������
��ͼ��ʾװ����һ�ֿɳ���أ�װ��IIΪ���أ����ӽ���Ĥֻ����Na+ͨ������ŵ�Ļ�ѧ����ʽΪ2Na2S2+NaBr3$?_{���}^{�ŵ�}$Na2S4+3NaBr���պϿ���Kʱ��b�������ȱ��ɫ������˵����ȷ���ǣ�������| A�� | ������ӦΪ2S22--2e-=S42- | |
| B�� | ����0.01 mol Na+ͨ�����ӽ���Ĥʱ��b�缫����������112 mL | |
| C�� | �պ�K��b�缫������pH��С | |
| D�� | �պ�K��a�缫����������� |
���� ���պϿ���Kʱ��b������Һ�ȱ�죬��b���������������ɣ�������b���ϵõ�������������b����������a�������������������ӵ���ԭ��صĸ���������B���Ǹ�����A�����������ٸ���ԭ��ء�����ԭ���ж�ѡ�
A��ԭ��صĸ�������ʧ���ӵ�������Ӧ��
B�����ݵ����غ�֪ʶ�����㣻
C���պ�K��b�缫������Һ�ȱ�죬��b���������������ɣ�
D���պϿ���Kʱ������a���Ϸ����ĵ缫��Ӧ��������
��� �⣺���պϿ���Kʱ��b������Һ�ȱ�죬��b���������������ɣ�������b���ϵõ�������������b����������a�������������������ӵ���ԭ��صĸ���������B���Ǹ�����A����������
A���պ�Kʱ����������������Ӧ���缫��ӦΪ2S22--2e-=S42-����A��ȷ��
B���պ�Kʱ����0.01molNa+ͨ�����ӽ���Ĥ��˵����0.01mol����ת�ƣ�����������0.005molH2����״�������Ϊ0.005mol��22.4L/mol=0.112L=112 mL��û��˵����״������B����
C���պϿ���Kʱ��b�������ȱ��ɫ���ü����������ӷŵ�Ĺ��̣���b���������������ɣ�pH����C����
D���պϿ���Kʱ��a�����������ü��Ͻ���ͭ�缫�ǻ��õ缫�������ĵ缫��ӦΪ��Cu-2e-=Cu2+��û�������������D����
��ѡA��
���� ���⿼��ѧ��ԭ��غ͵��صĹ���ԭ��֪ʶ�������ۺ�֪ʶ�Ŀ��飬�ۺ��Խ�ǿ���ѶȽϴ�

| A�� | ���� | B�� | �Ҵ� | C�� | �������� | D�� | ���� |
��2����ͼ1���߱�ʾ���ֶ�����Ԫ�ص�ԭ��������������˳�����У����䳣�����ʷе�Ĺ�ϵ������A���ʾ�ĵ�����F2���ѧʽ����
| ����/��pm�� | B-F | B-Cl | B-Br |
| ����ֵ | 152 | 187 | 199 |
| ʵ��ֵ | 130 | 175 | 187 |
��4������Ʒ���Ӽ��������������Na+���������������ɵģ�ij�ֶ��������Ľṹ��ͼ2��
����ԭ�ӵ��ӻ�����Ϊsp3��
�����ֶ�������ƵĻ�ѧʽΪNan+1PnO3n+1��
��5����֪HF��F-ͨ�������ϳ�HF2-���ж�HF2-��HF2-�����ܷ��γ��������˵�����ɣ���HF2-�У��Ѿ����ڷ����������F-H��F-��������û�п������γɷ��Ӽ��������ԭ�ӣ���HF2-��HF2-���䲻���γ������

| A�� | ��Һ��Ca2+��Ŀ���� | B�� | c��Ca2+������ | ||
| C�� | ��Һ��c��OH-������ | D�� | ��Һ��OH-��Ŀ���� |
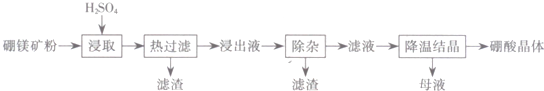
��֪����һ����ͬ�¶���H3BO3���ܽ��
| �¶ȡ棩 | 20 | 40 | 60 | 100 |
| �ܽ�ȣ�g�� | 5.0 | 8.7 | 14.8 | 40.2 |
| ���� | Fe��OH��3 | Al��OH��3 | Fe��OH��2 | Mg��OH��2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
��2��������Һ�������ԣ�����H3BO3��Mg2+��SO42-��������Fe2+��Fe3+��Ca2+��Al3+�����ʣ������ӡ�ʱ�������Һ�����μ�������ĿH2O2��MgO�����Գ�ȥ����������ΪFe3+��Fe2+��Al3+��������ΪH2O2+2H++2Fe2+=2Fe3++2H2O�������ӷ���ʽ��ʾ����
��3������ȡ�����á��ȹ��ˡ���Ŀ��Ϊ��ֹ�¶��½�ʱH3BO3����Һ��������
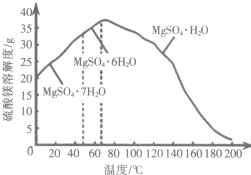
��4����ĸҺ�������ڻ�������þ����֪����þ���ܽ�����¶ȱ仯��������ͼ��ʾ������Һ�ķе���ѹǿ��������ߣ�Ϊ�˴ӡ�ĸҺ���г�ֻ��� MgSO4��H2O��Ӧ��ȡ�Ĵ�ʩ�ǽ���ĸҺ������Ũ������ѹ���½ᾧ��
��5����֪25��ʱ�����ᣨ H3BO3����Һ�д�������ƽ�⣺HBO3��aq��+H2O��l��?[B��OH��4]-��aq��+H+��aq�� K=5.7��10-10��25��ʱ��0.7mol��L-1������Һ��c��H��+��2��10-5mol��L-1
��6����֪25��ʱ��
| ��ѧʽ | H2CO3 | CH3COOH |
| ���볣�� | K1=4.4��10-7 K2=4.7��10-11 | K=1.75��10-5 |
A��̼������Һ����������Һ���ܹ۲쵽�����ݲ���
B��̼������Һ���������Һ���ܹ۲쵽�����ݲ���
C����Ũ��̼����Һ��������Һ��pH��ǰ�ߣ�����
D����Ũ��̼������Һ�ʹ�������Һ��pH��ǰ�ߣ����ߣ�