题目内容
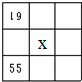
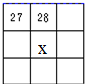
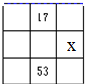
17.下列4种化合物分别经催化加氢后,不能得到2-甲基戊烷的是( )| A. |  | B. | 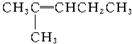 | C. | 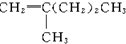 | D. | 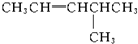 |
分析 根据烯烃的加成原理,双键中的一个键断开,结合H原子,生成2-甲基戊烷,采取倒推法相邻碳原子之间各去掉1个氢原子形成双键,即得到烯烃.
解答 解:2-甲基戊烷的碳链结构为 ,2-甲基戊烷相邻碳原子之间各去掉1个氢原子形成双键,从而得到烯烃;根据2-甲基戊烷的碳链结构知,相邻碳原子上各去掉1个氢原子形成双键的碳链结构有:
,2-甲基戊烷相邻碳原子之间各去掉1个氢原子形成双键,从而得到烯烃;根据2-甲基戊烷的碳链结构知,相邻碳原子上各去掉1个氢原子形成双键的碳链结构有:
 、
、 、
、 ,故A错误.
,故A错误.
故选A.
点评 本题考查了根据烷烃的结构判断烯烃的结构,难度较大,会根据烷烃结构去掉相邻氢原子形成碳碳双键,注意不能重写、漏写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.(1)与铜同周期、基态原子最外层电子数相同的过渡元素,它位于周期表中d区,其基态原子的电子排布式为[Ar]3d54s1.
(2)如图1曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是F2(填化学式).
(3)三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子间还有π键形成.
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图2.
①磷原子的杂化类型为sp3.
②这种多聚磷酸钠的化学式为Nan+1PnO3n+1.
(5)已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键.
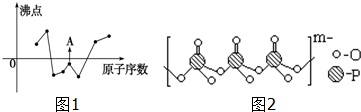
(2)如图1曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是F2(填化学式).
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图2.
①磷原子的杂化类型为sp3.
②这种多聚磷酸钠的化学式为Nan+1PnO3n+1.
(5)已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键.

5.下列实验一定能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 在食盐水中通入氟气置换出氯气 | 证明氟的非金属性强于氯 |
| B | 将滴有酚酞试液的氨水分成两份,并加热其中一份溶液 | 研究温度对弱电解质电离的影响 |
| C | 分别用玻璃棒蘸c(H+)相同的乙二酸和乙酸溶液,点在pH试纸上,并与标准比色卡对比 | 比较乙二酸和乙酸的酸性强弱 |
| D | 室温下,分别向体积、浓度均相同的Na2S2O3溶液中加入相同体积、不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
2.等物质的量浓度的下列稀溶液:①CH3COONa溶液;②Na2CO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )
| A. | 氨水 | B. | 硅酸钠溶液 | C. | NaOH溶液 | D. | NaHCO3溶液 |
6.下列关于苯的说法中,正确的是( )
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
7.相同条件下,用下列物质做氧化剂收集相同Cl2消耗浓盐酸最多的是( )
| A. | MnO2 | B. | KMnO4 | C. | NaClO | D. | KClO3 |