��Ŀ����
����Ŀ��������(H3PO2)��һ�־�ϸ������Ʒ�����н�ǿ��ԭ�ԣ��ش��������⣺
��1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ��___________��
��2��H3PO2��NaH2PO2���ɽ���Һ�е������ӻ�ԭΪ�����ʣ��Ӷ������ڻ�ѧ������
��(H3PO2)�У���Ԫ�صĻ��ϼ�Ϊ___________��
������(H3PO2)���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4:1������������Ϊ��___________(�ѧʽ)��
��NaH2PO2�� ���λ�����ʽ�Σ�___________������Һ��___________��(������ԡ��������ԡ������ߡ������ԡ�)��
��3��H3PO2�Ĺ�ҵ�Ʒ��ǣ�������(P4)������������Һ��Ӧ����PH3�����Ba(H2PO2)2�������������ᷴӦ��д������������������Һ��Ӧ�Ļ�ѧ����ʽ___________��
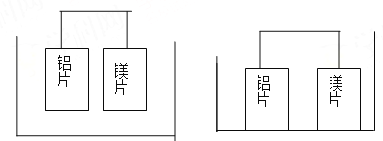
��4��(H3PO2)Ҳ����ͨ�����ķ����Ʊ�������ԭ����ͼ��ʾ(��Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ��):

��д�������ĵ缫��Ӧʽ___________��
�ڷ�����Ʒ�ҿɵõ�H3PO2��ԭ��___________��
�����ڲ��á����ҵ����������Ʊ�H3PO2���������ҵ����������������ҵ�ϡ������H3PO2ϡ��Һ���棬����ȥ���������Ʒ��֮�����Ĥ���Ӷ��ϲ������������Ʒ�ң���ȱ����___________�����������ʲ�����ԭ����___________��
���𰸡�
��1��H3PO2![]() H2PO2-+H+��
H2PO2-+H+��
��2����+1����H3PO4�������Σ����ԣ�
��3��2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3����
��4����4OH--4e-=O2��+2H2O���������ҵ�H+������Ĥ��ɢ����Ʒ����ԭ���ҵ�H2PO2-������Ĥ��ɢ����Ʒ�������߷�Ӧ����H3PO2����PO43-��H2PO2-��H3PO2������
��������
�����������1��H3PO2��һԪ��ǿ������Һ�в��ֵ��������������������뷽��ʽΪH3PO2![]() H2PO2-+H+���ʴ�Ϊ��H3PO2
H2PO2-+H+���ʴ�Ϊ��H3PO2![]() H2PO2-+H+��
H2PO2-+H+��
��2����H3PO2�У��ܻ��ϼ�Ϊ0��������Ԫ��Ϊ+1�ۣ���Ԫ��Ϊ-2�ۣ���PԪ�صĻ��ϼ�Ϊ+1�ۣ��ʴ�Ϊ��+1��
�ڸ÷�Ӧ��Ag+Ϊ��������H3PO2Ϊ��ԭ�����������뻹ԭ�������ʵ���֮��Ϊ4:1���跴Ӧ������P�Ļ��ϼ�Ϊx�����ݻ��ϼ�������ȿɵã�4��(1-0)=1��(x-1)�����x=5��������������Ϊ+5�۵�H3PO4���ʴ�Ϊ��H3PO4��
������H3PO2��һԪ��ǿ�ᣬ����NaH2PO2ΪһԪǿ���һԪ��ǿ���γɵ����Σ����Ը�����Һ����H2PO2-����ˮ��ʼ��ԣ�����ʽΪH2PO2-+H2OH3PO2+OH-���ʴ�Ϊ�����Σ����ԣ�
��3������(P4)��Ba(OH)2��Һ��Ӧ����PH3�����Ba(H2PO2)2����Ӧ����ʽΪ2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3�����ʴ�Ϊ��2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3����
��4��������������������Ϊ��������ӡ����������Ӻ�H2PO2-�����зŵ�������ǿ�������������ӣ������������ĵ缫��ӦΪ��4OH--4e-=O2��+2H2O���ʴ�Ϊ��4OH--4e-=O2��+2H2O��
�ڲ�Ʒ�ҿɵõ�H3PO2��ԭ������Ϊ�������ҵ�H+������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2-������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2���ʴ�Ϊ�������ҵ�H+������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2-������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2
�����ڲ��á����ҵ����������Ʊ�H3PO2���������ҵ����������������ҵ�ϡ������H3PO2ϡ��Һ���棬����ȥ���������Ʒ��֮�����Ĥ���Ӷ��ϲ������������Ʒ�ң���ȱ���������������������H2PO2-��H3PO2������PO43-����Ʒ�л���PO43-���ʴ�Ϊ��PO43-��H2PO2-��H3PO2��������