题目内容
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是

A. 原电池的总反应为 Fe+Cu2+=Fe2++Cu
B. 反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C. 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D. 盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
【答案】D
【解析】试题分析:A.负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-=Cu,则原电池的总反应为Fe+Cu2+═Fe2++Cu,故A正确;B.Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
解得:n=0.2mol,故B正确;C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,溶液中的氢离子在正极上得电子,则石墨电极反应式为2H++2e-═H2↑,故C正确;D.盐桥中是KNO3溶液,则盐桥中NO3-移向负极移动,即向甲烧杯,故D错误;故选D。

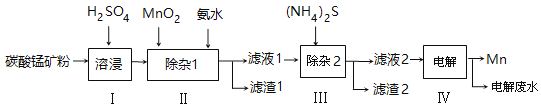
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)