题目内容
【题目】I.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度= ,
(2)B的平均反应速率v(B)= ,
(3)x= ,
(4)开始时容器中的压强与平衡时的压强之比为 (化为最箭整数比)
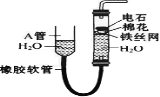
II.将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)

(5) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(6)当消耗甲烷的体积为11.2 L(标准状况下)时,则消耗KOH的物质的量为 。
(7)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4gNH3转移的电子数目为 。
【答案】
I.(1)1.2mol/L;(2)0.12mol/(Lmin);(3)3;(4)10:11;
II.(5)B;CH4 -8e- +10OH-═CO32- +7H2O;(6)1mol;(7)2NH3+6OH- -6e- =N2 +6H2O;0.6NA。
【解析】
试题分析:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转
化率为60%,则 3A(g)+B(g)![]() xC(g)+2D(g),
xC(g)+2D(g),
开始(mol/L) 3 3 0 0
转化(mol/L)3×60% 0.6 0.6x 1.2
平衡(mol/L) 1.2 2.4 0.6x 1.2
(1)由上述分析可知平衡状态D的浓度为1.2mol/L;(2)B的平均反应速率υ(B)=0.6mol/L ÷ 5min =0.12mol/(Lmin);(3)由速率之比等于化学计量数之比可知,1/x=0.12/0.36,解得x=3;(4)开始时容器中的压强与平衡时的压强之比等于反应前后的物质的量之和的比,为(6+6)mol:(1.2+2.4+0.6×3+1.2)mol/L×2L=10:11;II.(5)根据电子流向知,B为负极、A为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以B处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4 -8e- +10OH-═CO32- +7H2O;(6)甲烷的物质的量为n(CH4)= 11.2L÷22.4L/mol=0.5mol,根据CH4 -8e- +10OH-═CO32- +7H2O可知反应消耗KOH的物质的量为甲烷物质的量的10倍,所以消耗氢氧化钾的物质的量是1mol;(7)电池反应为:4NH3+3O2=2N2+6H2O,该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH- -6e- =N2 +6H2O,反应中2mol氨气反应电子转移6mol电子,每消耗3.4g NH3物质的量n(NH3)=3.4g÷17g/mol=0.2mol,转移的电子数为0.6NA。

 阅读快车系列答案
阅读快车系列答案