题目内容
【题目】 “侯氏制碱法”是我国化工行业历史长河中一颗璀璨明珠。
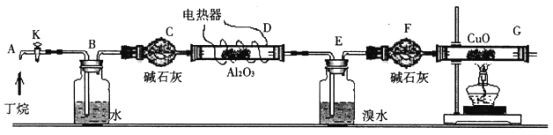
Ⅰ..纯碱的制备:用下图装置制取碳酸氢钠,再间接制得纯碱。

(1)装置乙的作用是 _________________,其中水可以用_______________代替;
(2)装置丙中反应的化学方程式为_____________________________________;
(3)用装置丙中产生的碳酸氢钠制取纯碱时,需要的实验操作有:_____________。
(4)定量分析:测定纯碱样品纯度
提供药品:酚酞、甲基橙、0.1mol/LHCl溶液
实验步骤:
①称取样品mg,溶于水形成100mL溶液;
②向溶液中滴加少量___________作指示剂,再向其中滴加盐酸溶液至终点,消耗盐酸_________VmL;
③计算:纯碱样品纯度=__________________。
Ⅱ.某小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:加热0.1mol/LNaHCO3溶液,测得溶液pH随温度变化的曲线:

当温度恢复到10℃,测得溶液 pH=11.5。
(5)依据图像信息对下列问题做出合理猜测:
①AB段pH上升原因:____________________________________________________,
②BC段pH上升原因:____________________________________________________;
(6)设计实验对BC段pH上升的合理猜测进行验证(药品任意选择):__________________________。
【答案】
(1)除去二氧化碳中混有的氯化氢气体 饱和碳酸氢钠溶液 ;
(2)NH3·H2O+CO2+NaCl=NaHCO3↓+NH4Cl
(3)过滤、洗涤、灼烧
(4)酚酞 0.0106V/m (或甲基橙,(0.0084V-m)/62m)
(5)①HCO3-+H2O![]() H2CO3+OH-,△H>0;升温促进水解平衡正向移动,pH上升
H2CO3+OH-,△H>0;升温促进水解平衡正向移动,pH上升
②2NaHCO3![]() Na2CO3+CO2↑+H2O,温度较高时,使得碳酸氢钠受热分解为碳酸钠,溶液碱性增强
Na2CO3+CO2↑+H2O,温度较高时,使得碳酸氢钠受热分解为碳酸钠,溶液碱性增强
(6)取回复至室温的溶液少许,向其中滴加氯化钡溶液,产生白色沉淀,说明猜测合理。
【解析】
试题分析:Ⅰ.(1)盐酸有挥发性,制得的CO2中混有少量HCl,故乙装置的作用是除去二氧化碳中混有的氯化氢气体,可以用饱和碳酸氢钠溶液代替水吸收HCl;
(2)装置丙是侯氏制碱原理,发生的反应方程式为NH3·H2O+CO2+NaCl=NaHCO3↓+NH4Cl;
(3)从反应后的混合物中提出不溶物需要过滤并洗涤,最后加热灼烧使之完全分解得到纯碱,具体需要的实验操作有过滤、洗涤、灼烧;
(4)②用盐酸滴定纯碱溶液选择酚酞作指示剂;
③滴定过程发生的反应为Na2CO3+HCl=NaHCO3+H2O,n(Na2CO3)=n(HCl)=0.1V×10-3mol,样品的纯度为![]() ×100%=0.0106V/m;
×100%=0.0106V/m;
Ⅱ.(5)①AB段pH上升原因是溶液里存在HCO3-+H2O![]() H2CO3+OH-,△H>0;升温促进水解平衡正向移动,pH上升;
H2CO3+OH-,△H>0;升温促进水解平衡正向移动,pH上升;
②BC段pH上升原因是碳酸氢钠不稳定,受热分解生成碳酸钠,碳酸钠的水解程度大于碳酸氢钠,溶液碱性增强;
(6)结合碳酸钠与碳酸氢钠的性质差异,取回复至室温的溶液少许,向其中滴加氯化钡溶液,产生白色沉淀,说明溶液里含有碳酸钠,猜测合理。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案