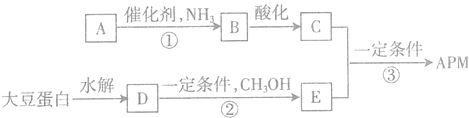
题目内容
【题目】(1)在催化剂作用下,CO2和H2可以制取甲醇.用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2![]() CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

写出由二氧化碳和氢气制备甲醇的热化学方程式: .
(2)硼氢化钠(NaBH4)是有机合成中的重要还原剂.最新研究发现,以NaBH4(硼元素的化合价在该过程中不发生变化)和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:

电极b为 (填“正极”或“负极”),
电极a上发生反应的电极反应式为 .
(3)电池工作时,Na+向 极(填“a”或“b”)移动,
当左槽产生0.0125mol BO2﹣离子时,右槽溶液c(OH-)
【答案】(1)CO2(g)+3H2(g)═CH3OH(l)+H20(l)△H=﹣50kJ/mol
(2)正极 BH4﹣+8OH﹣﹣8e﹣=BO2﹣+6H2O
(3)b 0.1mol/L
【解析】
试题分析:(1)图象分析书写热化学方程式为:①CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ/mol,②CO(g)+2H2(g)=CH3OH(l)△H=-91KJ/mol;依据盖斯定律②-①得到:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol。
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
(2)根据图示内容,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O。
故答案为:正;BH4-+8OH--8e-=BO2-+6H2O;
(3)原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,根据电极反应:BH4-+8OH--8e-=BO2-+6H2O,当左槽产生0.0125mol BO2-离子时,转移电子是0.1mol,此时根据正极上电极反应H2O2+2e-=2OH-,则生成氢氧根离子的物质的量是0.1mol,则氢氧根离子浓度是0.1mol/L。
故答案为:b;0.1mol/L。

 千里马走向假期期末仿真试卷寒假系列答案
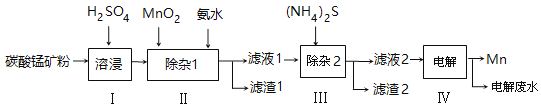
千里马走向假期期末仿真试卷寒假系列答案【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)