题目内容
9.铊(Tl)与铝同族.Tl3+在酸性溶液中能发生反应:Tl3++2Ag→Tl++2Ag+.下列推断错误的是( )| A. | Tl+的最外层有1个电子 | B. | Tl能形成+3价和+1价的化合物 | ||
| C. | 酸性溶液中Tl3+比Tl+氧化性强 | D. | Tl+的还原性比Ag弱 |
分析 A、铊与铝同族,最外层有3个电子,以此判断Tl+离子的最外层电子数;
B、根据离子反应可知Tl的化合物的存在形式有两种;
C、氧化还原反应中氧化剂的氧化性最强;
D、根据还原剂的还原性大于还原产物的还原性来分析.
解答 解:A、铊与铝同族,最外层有3个电子,则Tl+离子的最外层有2个电子,故A错误;
B、根据反应Tl3++2Ag═Tl++2Ag+可知,Tl能形成+3价和+1价的化合物,故B正确;
C、Tl3++2Ag═Tl++2Ag+,氧化还原反应中氧化剂的氧化性最强,则Tl3+的氧化性最强,所以Tl3+比Tl+氧化性强,故C正确;
D、还原剂的还原性大于还原产物的还原性来分析,在反应Tl3++2Ag=Tl++2Ag+,还原性Ag>Tl+,故D正确.
故选A.
点评 本题考查铊与铝的性质比较,以及物质氧化性还原性的比较等问题,题目难度不大,注意把握比较问题的方法.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 碘元素遇淀粉溶液均变蓝色 | |
| B. | 质子数为86、中子数为51的氡原子可表示为:$\stackrel{137}{86}$Rn | |
| C. | CS2的电子式::$\underset{\stackrel{..}{S}}{..}$:$\underset{\stackrel{..}{C}}{..}$:$\underset{\stackrel{..}{S}}{..}$: | |
| D. | 6.0g醋酸晶体中含有H+的数目为0.1NA |
17.化学与社会、生产、生活紧密相关,下列说法正确的是( )
| A. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| B. | 自来水可用氯气来杀菌消毒.说明氯气无毒 | |
| C. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
4.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A. | 稀硝酸 | B. | 硝酸铜 | C. | 稀盐酸 | D. | 氢氧化钠 |
1.实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸 |
18.用如图示的方法可以保护钢质闸门.下列说法正确的是( )


| A. | 当a、b间用导体连接时,则X应发生氧化反应 | |
| B. | 当a、b间用导体连接时,则X可以是锌或石墨 | |
| C. | 当a、b与外接电源相连时,a应连接电源的正极 | |
| D. | 当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
19.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00 mol•L-1 NaCl溶液中含有Na+的数目为NA | |
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA | |
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |

 .
. .
. .
. .
. .
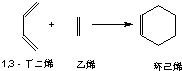
.
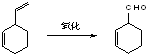
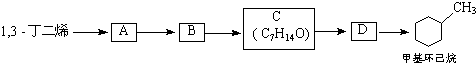
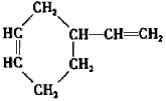 ;B
;B