题目内容
11. 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )| A. | NaNO3溶液 | B. | 四氯化碳 | C. | 苯 | D. | Na2CO3溶液 |
分析 加入的物质应该具备以下条件:不能和容器中的物质反应生成其它气体;能够让稀硫酸和锌混合生成氢气.
解答 解:A.因加入NaNO3溶液,相当于稀硫酸进行稀释,同时液面上升,但溶液中含有NO3-,与金属发生反应,产生NO,故A错误;
B.CCl4和硫酸、锌都不反应,所以不影响氢气,四氯化碳密度大于硫酸溶液,所以沉在底部,使硫酸液面上升,与锌继续反应生成氢气,故B正确;
C.因苯不溶于水,且密度比水小,加入苯,液面上升,苯在上层,但苯与金属锌不反应,不会产生氢气,故C错误;
D.Na2CO3溶液和硫酸反应生成二氧化碳,所以能引入杂质二氧化碳影响氢气的纯度,故D错误;
故选:B.
点评 本题为实验题,考查了常见物质的性质,注意硝酸根离子在酸性环境下能够与金属反应,但是一定不会生成氢气,题目难度不大.

练习册系列答案
相关题目
1.实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸 |
2.下列措施对增大化学反应速率明显增大的是( )
| A. | 使用催化剂 | B. | 增加压强 | C. | 增大反应物浓度 | D. | 升高温度 |
19.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00 mol•L-1 NaCl溶液中含有Na+的数目为NA | |
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA | |
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
16.某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为:2FeCl3+Cu→2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g.(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.下列关于原废液及其形成的判断正确的是( )
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
7.向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是( )
| A. | 硝酸亚铁溶液中加入稀硫酸 | |
| B. | 含有酚酞的碳酸钠溶液中加入足量的氧化钙溶液 | |
| C. | 硫酸铜溶液中滴加硝酸钡溶液 | |
| D. | 高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |
4.利用下列实验器材(规格和数量不限)不能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、坩埚、坩埚钳、酒精灯、三脚架 | 灼烧FeCl3固体 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸、带铁圈的铁架台 | 用NaOH溶液除去Fe粉中少量Al |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、量筒 | 用10mol•L-1的硫酸配置0.1mol•L-1的硫酸 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
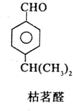 $→_{一定条件}^{试剂X}$A
$→_{一定条件}^{试剂X}$A B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$
B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$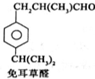
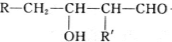 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$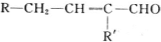
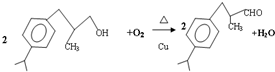 +H20.
+H20.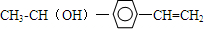 、
、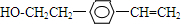 .
.