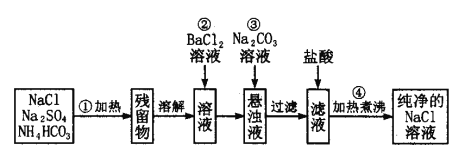
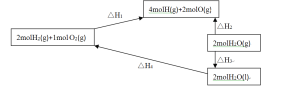
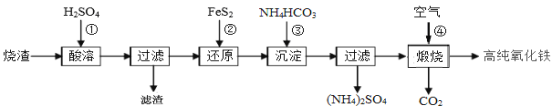
题目内容
【题目】将一定质量Mg、Zn、Al的混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),则原混合物的质量不可能是( )
A.2g B.4g C.6g D.8g
【答案】A
【解析】
试题分析:标况下,2.8L氢气的物质的量为![]() =0.125mol,设要生成0.125mol H2需要锌的质量为x,则:Zn+H2SO4═ZnSO4+H2↑
=0.125mol,设要生成0.125mol H2需要锌的质量为x,则:Zn+H2SO4═ZnSO4+H2↑
65g 1mol
x 0.125mol
解得x=![]() =8.125g
=8.125g
设要生成H2 0.125mol需要铝的质量为y,则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
54g 3mol
y 0.125mol
解得y=![]() =2.25g
=2.25g
所以混合物的质量介于2.25g~8.125g,不可能是2g,故选:A。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目