题目内容
【题目】已知H2+Cl2![]() 2HCl,一定条件下,某H2和Cl2的混合气体7.5 g 含有3.612×1023个原子,充分反应后,下列说法正确的是( )
2HCl,一定条件下,某H2和Cl2的混合气体7.5 g 含有3.612×1023个原子,充分反应后,下列说法正确的是( )
A.反应后所得气体比相同状况下空气的密度大
B.反应后所得气体在标准状况下的体积为6.72L
C.反应后所得气体中H原子和Cl原子的物质的量之比为1:2
D.反应后所得气体可被100mL 1mol/L NaOH溶液完全吸收
【答案】B
【解析】
试题分析:含有3.612×1023个原子的混合气体的物质的量═![]() ×
×![]() =0.3mol,A.反应前后气体的物质的量不变,所以反应前后气体的摩尔质量不变,混合气体的平均摩尔质量=
=0.3mol,A.反应前后气体的物质的量不变,所以反应前后气体的摩尔质量不变,混合气体的平均摩尔质量=![]() =25g/mol<29g/mol,所以反应后所得气体比相同状况下空气的密度小,故A错误;B.反应前后气体的物质的量不变,则其体积不变,则混合气体的体积=V=nVm=0.3mol×22.4L/mol=6.72L,故B正确;C.设氢气的物质的量为x,氯气的物质的量为y,由x+y=0.3,2x+71y=7.5解得x=0.2,y=0.1,氢气和氯气的物质的量之比为0.2mol:0.1mol=2:1,氢气和氯气都是双原子分子,所以H原子和Cl原子个数之比为2:1,故C错误;D.氢气和氯气的物质的量分别是0.2mol、0.1mol,二者完全反应氢气有剩余,生成0.2molHCl,氢氧化钠的物质的量=1mol/L×0.1L=0.1mol,根据HCl+NaOH=NaCl+H2O知,氯化氢有剩余,故D错误;故选B。
=25g/mol<29g/mol,所以反应后所得气体比相同状况下空气的密度小,故A错误;B.反应前后气体的物质的量不变,则其体积不变,则混合气体的体积=V=nVm=0.3mol×22.4L/mol=6.72L,故B正确;C.设氢气的物质的量为x,氯气的物质的量为y,由x+y=0.3,2x+71y=7.5解得x=0.2,y=0.1,氢气和氯气的物质的量之比为0.2mol:0.1mol=2:1,氢气和氯气都是双原子分子,所以H原子和Cl原子个数之比为2:1,故C错误;D.氢气和氯气的物质的量分别是0.2mol、0.1mol,二者完全反应氢气有剩余,生成0.2molHCl,氢氧化钠的物质的量=1mol/L×0.1L=0.1mol,根据HCl+NaOH=NaCl+H2O知,氯化氢有剩余,故D错误;故选B。

【题目】中和热的测定是重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
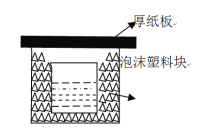
(1)从图中实验装置看,其中尚缺少的两种玻璃用品是_,为保证该实验成功,该同学采取了许多措施,如图的泡沫塑料块的作用在于。
(2)倒入NaOH溶液的正确操作是:(从下列选出)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
D.简述测量温度的方法
(3)实验记录数据如表
项目 | 反应起始温度T1(℃) | 终止温度T2(℃) | T2-T1 | ||
HCl | NaOH | 平均温度 | |||
第1次 | 26.2 | 26.0 | 29.4 | ||
第2次 | 27.0 | 27.4 | 32.2 | ||
第3次 | 25.9 | 25.9 | 29.1 | ||
第4次 | 26.4 | 26.2 | 29.7 | ||
设0.55mol/LNaOH溶液和0.50mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=(取到小数点后一位)。
(4)不能用醋酸代替盐酸做此实验,原因是____________________。