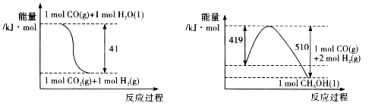
题目内容
【题目】I.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。其中正确的操作顺序是 。
A①④②⑤③ B④①②⑤③ C②⑤④①③ D⑤②④①③ E①②⑤④③
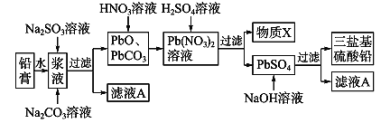
II.实验室里需要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:
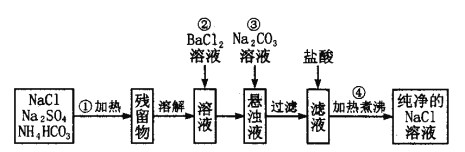
(1)操作①中发生的化学反应方程式为:NH4HCO3![]() NH3↑+CO2↑+H2O↑
NH3↑+CO2↑+H2O↑
则可选择________容器进行加热(选填:试管、量筒、容量瓶、分液漏斗)
(2)操作②反应的化学反应方程式为: ,能否用硝酸钡溶液代替氯化钡 (填“能”或“不能”)原因是: ;
(3)为了达到实验目的,进行操作②后,如何判断溶液中SO42-已除尽,其方法有_________。
A.静置,向上层清液中滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
B.静置,取上层清液于试管中,滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
C.静置,向上层清液中滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
D.静置,取上层清液于试管中,滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
E.静置,取上层清液于试管中,滴加硝酸银溶液,若有沉淀生成,则说明原溶液中的SO42-已除尽
【答案】
I.CD
II.(1)试管
(2)Na2SO4+BaCl2==BaSO4↓+2NaCl 不能 引进了硝酸根离子,难除去
(3)BD
【解析】
试题分析:I.Mg2+用氢氧根离子沉淀,加过量的NaOH溶液可以将镁离子沉淀;SO42-用钡离子沉淀,加入⑤加过量的BaCl2溶液可以将硫酸根离子沉淀;先除镁离子,还是先除硫酸根离子都行,Ca2+用碳酸根离子沉淀,加入④加过量的Na2CO3溶液除去钙离子,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,然后进行①过滤,最后再加入HCl除去反应剩余的氢氧根离子和碳酸根离子,所以选CD。
(1)操作①是将NH4HCO3加热分解,可在试管中进行。
(2)钡离子能与硫酸根反应生成硫酸钡沉淀:Ba2++SO42-=BaSO4↓,方程式为Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl;如果改用硝酸钡会使溶液中引入新的杂质离子硝酸根,而在以后操作中无法除去,所以不能用硝酸钡溶液。
(3)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,故选BD。

 名校课堂系列答案
名校课堂系列答案【题目】四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
W | X | Y | Z | |
结构 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元 | 最高正价与最 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的四种水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
A.自然界中的含量 B.相应氯化物水溶液的pH
C.单质与水反应的难易程度 D.单质与酸反应时失去的电子数
②W、X、Y的离子半径由大到小的顺序为 。(填对应的离子符号)
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ,混合后溶液中离子浓度由大到小的顺序是 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中Y的质量分数的数据有 (填序号)。
A.m、n B.m、y C.n、y