题目内容
【题目】高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
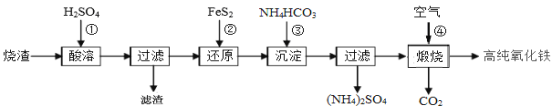
(1)酸浸时,常需将烧渣粉碎、并加入过量H2SO4,其目的是 ;
滤渣的主要成分为 (填化学式)。
(2)加入FeS2时,发生反应②的离子方程式为 。
(3)加入NH4HCO3目的是 。“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 。检验FeCO3是否洗涤干净的方法是 。
(4)煅烧时,发生反应④的化学方程式为 。
【答案】(1)提高铁元素的浸出率,同时抑制铁离子的水解(2分)SiO2(1分)
(2)FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+(2分)
(3)中和溶液中的酸,调节溶液的pH,使Fe2+全部转化为FeCO3(2分)
Fe(OH)2(1分)取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净。(2分)
(4)4FeCO3+O2![]() 2Fe2O3+4CO2(2分)
2Fe2O3+4CO2(2分)
【解析】
试题解析: (1)酸浸时,常需将烧渣粉碎、增大烧渣与酸的接触面积,并加入过量H2SO4,除了使烧渣中的部分氧化物溶解外,还能抑制铁离子的水解。酸性氧化物SiO2不与酸反应。(2)加入FeS2时,把铁离子还原为Fe2+:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42-+16H+ (3)加入NH4HCO3目的是中和溶液中的酸,调节溶液的pH,使Fe2+全部转化为FeCO3;亚铁离子的水解能力较强,易发生水解,“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是Fe(OH)2 ;检验FeCO3固体中附着有硫酸根离子,可以用盐酸和氯化钡溶液进行检验,取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净。(4)在空气中煅烧FeCO3,二价铁被氧化为三价铁,进一步得到Fe2O3。4FeCO3+O2![]() 2Fe2O3+4CO2 ;
2Fe2O3+4CO2 ;
考点: 物质的制备流程相关问题。