题目内容
5.根据题意回答下列问题(1)写出基态Fe2+离子核外电子排布式[Ar]3d5或1s22s22p63s23p63d6;基态氟原子价电子排布图
 .
.(2)电负性:S<O(填写“<”或“>”,下同));第一电离能:N< F.H3O+空间构型是三角锥,SO32-离子中S杂化类型是sp3.
(3)HCN分子中σ键与π键数目之比为1:1.
(4)与CN?互为等电子体的分子是N2(写分子式).
分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式;基态氟原子价电子排布为2s22p5,以此书写排布图;
(2)同主族元素从上到下电负性逐渐减小;同周期元素从左到右第一电离能逐渐增大,ⅡA、ⅤA族大于相邻主族元素的第一电离能;判断δ键和孤电子对数,确定空间构型以及杂化类型;
(3)HCN分子含有C-H和C≡N键,以此确定σ键与π键数目之比;
(4)CN?含有2个原子,核外电子数为14.
解答 解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,则Fe2+核外电子排布式为[Ar]3d5或1s22s22p63s23p63d6;基态氟原子价电子排布为2s22p5,则电子排布图为 ,
,
故答案为:[Ar]3d5或1s22s22p63s23p63d6; ;
;
(2)同主族元素从上到下电负性逐渐减小,则电负性:S<O;同周期元素从左到右第一电离能逐渐增大,ⅡA、ⅤA族大于相邻主族元素的第一电离能,第一电离能N<F,
H3O+的O形成3个δ键,孤电子对数$\frac{6-1-3×1}{2}$=1,则空间构型是三角锥形,SO32-离子中的S形成3个δ键,孤电子对数$\frac{6+2-2×3}{2}$=1,则S杂化类型是sp3,
故答案为:<;<;三角锥;sp3;
(3)HCN分子含有C-H和C≡N键,含有2个σ键、2个π键,σ键与π键数目之比1:1,故答案为:1:1;
(4)CN?含有2个原子,核外电子数为14,与N2为等电子体,故答案为:N2.
点评 本题考查较为综合,涉及核外电子排布、电负性、电离能、杂化类型以及空间构型等知识的考查,为选修三常考内容,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
13.分子式为C5H10O2的羧酸共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
20.下列反应的反应条件正确的是( )
| 化学反应 | 反应条件 | |
| A | 由苯制取硝酸苯 | 浓硝酸、加热 |
| B | 由乙醇制取乙烯 | 稀硫酸、170℃ |
| C | 天然蛋白质水解生成α-氨基酸 | 浓硫酸加热 |
| D | 1-溴丁烷生成1-丁烯 | 氢氧化钠、乙醇,加热 |
| A. | A | B. | B | C. | C | D. | D |
10.下列说法中,正确的是( )
| A. | 甲醛、乙醛分子中的所有原子都在同一平面上 | |
| B. | 能发生银镜反应的有机物一定是醛 | |
| C. | 乙醛、丙醛都没有同分异构体 | |
| D. | 醛类既能氧化为羧酸又能还原为醇 |
17.下列关于 的说法正确的是( )
的说法正确的是( )
 的说法正确的是( )
的说法正确的是( )| A. | 所有原子可能都在同一平面上 | B. | 最多有9个碳原子在同一平面上 | ||
| C. | 只可能有5个碳原子在同一直线上 | D. | 有7个碳原子可能在同一直线上 |
14.下列说法中,不正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在气态单质分子中,不一定存在着共价键 | |
| C. | 原子晶体中,只存在共价键 | |
| D. | 含有离子键的化合物才是离子化合物 |
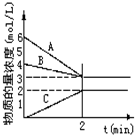 已知N2+3H2$?_{加热}^{催化剂}$2NH3+Q,根据图判断:
已知N2+3H2$?_{加热}^{催化剂}$2NH3+Q,根据图判断: