题目内容
4.已知Mg(OH)2的Ksp=1.35×10-11mol3•L-3,假设溶于水中的Mg(OH)2完全电离,试计算:(1)Mg(OH)2在水中的溶解度(mol•L-1);
(2)Mg(OH)2饱和溶液中的c(Mg2+)和c(OH-);
(3)Mg(OH)2在0.01mol•L-1NaOH溶液中的c(Mg2+);
(4)Mg(OH)2在0.01mol•L-1MgCl2中的溶解度(mol•L-1)
分析 (1)设出氢氧化镁饱和溶液中溶解的浓度为x,然后根据Ksp[Mg(OH)2]=c(Mg2+)•c2(OH-)列式计算;
(2)根据(1)的计算结果可知Mg(OH)2饱和溶液中的c(Mg2+)和c(OH-);
(3)氢氧根离子浓度为0.01mol/L,结合Ksp[Mg(OH)2]=c(Mg2+)•c2(OH-)计算出镁离子浓度;
(4)镁离子浓度为0.01mol/L,结合Ksp[Mg(OH)2]=c(Mg2+)•c2(OH-)可计算出该溶液中氢氧根离子浓度,从而得出氢氧化镁的溶解度.
解答 解:(1)Ksp[Mg(OH)2]=c(Mg2+)•c2(OH-)=1.35×10-11mol3•L-3,
设氢氧化镁饱和溶液中溶解的氢氧化镁的物质的量浓度为x,则c(Mg2+)=x、c(OH-)=2x,则:x×(2x)2=4x3=1.35×10-11mol3•L-3,
氢氧化镁的浓度为:x=$\root{3}{3.375×1{0}^{-12}}$mol/L=1.5×10-4mol•L-1,
答:Mg(OH)2在水中的溶解度为1.5×10-4mol•L-1;
(2)根据(1)可知,氢氧化镁饱和溶液中氢氧化镁的浓度为1.5×10-4mol•L-1,镁离子和氢氧根离子浓度都与氢氧化镁的浓度相等,则Mg(OH)2饱和溶液中c(Mg2+)=c(OH-)=21.5×10-4mol•L-1;
答:Mg(OH)2饱和溶液中c(Mg2+)=1.5×10-4mol•L-1、c(OH-)=1.5×10-4mol•L-1;
(3)0.01mol•L-1NaOH溶液中,c(OH-)=0.01mol/L,则c(Mg2+)=$\frac{{K}_{sp}}{{c}^{2}(O{H}^{-})}$=$\frac{1.35×1{0}^{-11}}{0.0{1}^{2}}$mol/L=1.35×10-7mol•L-1,
答:Mg(OH)2在0.01mol•L-1NaOH溶液中的c(Mg2+)为1.35×10-7mol•L-1;
(4)0.01mol•L-1MgCl2中镁离子浓度为0.01mol/L,则该溶液中:c2(OH-)=$\frac{1.35×1{0}^{-11}}{0.01}$=1.35×10-9,解得:c(OH-)=3.67×10-5mol/L,
则该溶液中氢氧化镁的浓度为:c[Mg(OH)2]=$\frac{1}{2}$c(OH-)=$\frac{1}{2}$×3.67×10-5mol/L=1.83×10-5mol/L,
答:Mg(OH)2在0.01mol•L-1MgCl2中的溶解度为1.83×10-5mol/L.
点评 本题考查了难溶物溶解平衡的计算、溶解度的计算,题目难度中等,明确溶度积的概念及表达式为解答关键,试题侧重考查学生的分析能力及化学计算能力.

| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在气态单质分子中,不一定存在着共价键 | |
| C. | 原子晶体中,只存在共价键 | |
| D. | 含有离子键的化合物才是离子化合物 |

| A. | 维生素A是一种不溶于水的物质 | |
| B. | 维生素A的1个分子中有3个碳碳双键 | |
| C. | 维生素A的1个分子中有20个氢原子 | |
| D. | 维生素A具有苯环的结构单元 |
| A. | 同位素(${\;}_{1}^{1}$H20与${\;}_{1}^{2}$H2O) | B. | 同素异形体(13C与C60) | ||
| C. | 同分异构体( 与CH3COOH) 与CH3COOH) | D. | 同系物(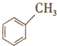 与 与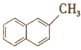 ) ) |
| A. | 氨易液化,因此可用来作制冷剂 | |
| B. | 氨极易溶于水,因此可用来作喷泉实验 | |
| C. | 氨极易溶于水,因此一水合氨比较稳定(不容易分解) | |
| D. | 氨溶于水显弱碱性,因此可使酚酞试剂变为红色 |

 Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物.请回答下列问题:
Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物.请回答下列问题: