题目内容
10.物质的转化关系如下图所示(有的反应可能在水溶液中进行).其中A为气体化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化.若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成.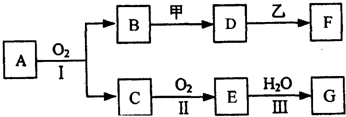
则(1)A的分子式是NH3,甲的电子式是
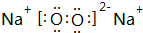 .
.(2)D的溶液与乙反应的离子方程式是2 Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8kJ/mol.
分析 甲为一种淡黄色固体,且为化合物,应为Na2O2,若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成,G为酸,应为HNO3(或HCl)和NH3的反应,由于G是由A经过两步氧化后与水反应得到的,所以G为HNO3,生成NH4NO3,且A能与O2反应,故A为NH3,则C为NO,E为NO2,B为H2O,D、F的溶液均呈碱性,过氧化钠与水反应得到D为NaOH,乙在G的浓溶液中发生钝化,则乙为铝或铁,且能与NaOH反应,所以乙为Al,F为NaAlO2.
解答 解:甲为一种淡黄色固体,且为化合物,应为Na2O2,若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成,G为酸,应为HNO3(或HCl)和NH3的反应,由于G是由A经过两步氧化后与水反应得到的,所以G为HNO3,生成NH4NO3,且A能与O2反应,故A为NH3,则C为NO,E为NO2,B为H2O,D、F的溶液均呈碱性,过氧化钠与水反应得到D为NaOH,乙在G的浓溶液中发生钝化,则乙为铝或铁,且能与NaOH反应,所以乙为Al,F为NaAlO2.
(1)A的分子式是NH3,甲为Na2O2,电子式是 ,
,
故答案为:NH3; ;
;
(2)D的溶液与乙反应的离子方程式是:2 Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2 Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)1.7g 氨气即为0.1mol,与O2反应生成气态的B和C时放出22.67kJ热量,则4mol氨气反应放出热量为22.67kJ×$\frac{4mol}{0.1mol}$=906.8kJ,该反应的热化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8kJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8kJ/mol.
点评 本题考查无机物的推断,物质的颜色、特殊性质、反应现象为推断的突破口,题目侧重于学生分析能力与元素化合物知识的考查,难度中等.

| 化学反应 | 反应条件 | |
| A | 由苯制取硝酸苯 | 浓硝酸、加热 |
| B | 由乙醇制取乙烯 | 稀硫酸、170℃ |
| C | 天然蛋白质水解生成α-氨基酸 | 浓硫酸加热 |
| D | 1-溴丁烷生成1-丁烯 | 氢氧化钠、乙醇,加热 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 |
①HClO3酸性比H2SO4强②HCl酸性比H2S强③HCl稳定性比H2S强④HCl还原性比H2S弱⑤Cl2与H2S反应生成S⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS⑦Na2S可与HCl反应生成H2S.
| A. | ①③⑤⑥ | B. | ②③④⑤⑥ | C. | ③⑤⑥⑦ | D. | ③④⑤⑥ |
| A. | 甲酸甲酯 | B. | 乙酸异丙酯 | C. | 麦芽糖 | D. | 蔗糖 |
| A. | 只用酸性KMnO4溶液 | B. | 只用溴水 | ||
| C. | 只用NaOH溶液 | D. | 用酸性KMnO4溶液和溴水 |
 诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )
诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )| A. | 能与氢气反应 | B. | 能与金属钠反应 | ||
| C. | 能与NaOH溶液反应 | D. | 不能与新制Cu(OH)2悬浊液反应 |
