题目内容
20.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述错误的是( )| A. | 负极附近SO42- 逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 反应一段时间后,溶液的H+浓度降低 | |
| D. | 铜片上有H2逸出 |
分析 铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;溶液中阴离子向负极移动,阳离子向正极移动;由此分析解答.
解答 解:A、该原电池放电时,溶液中阴离子向负极移动,阳离子向正极移动,所以硫酸根离子向负极移动,故A正确;
B、铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;原电池放电时,电子从负极锌沿导线流向正极铜,故B错误;
C、该原电池中正极上氢离子得电子生成氢气,导致溶液中氢离子浓度降低,故C正确;
D、正极上氢离子得电子生成氢气,所以铜片上有H2逸出,故D正确;
故选:B.
点评 本题考查了原电池原理,难度不大,易错点为:判断溶液中阴阳离子的移动方向.

练习册系列答案
相关题目
10.下列说法中,正确的是( )
| A. | 甲醛、乙醛分子中的所有原子都在同一平面上 | |
| B. | 能发生银镜反应的有机物一定是醛 | |
| C. | 乙醛、丙醛都没有同分异构体 | |
| D. | 醛类既能氧化为羧酸又能还原为醇 |
11.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物.下列关于MMF的说法正确的是( )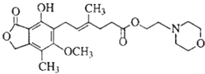

| A. | MMF能与碳酸钠溶液反应放出气体 | |
| B. | 1molMMF能与6mol氢气发生完全加成 | |
| C. | MMF遇三氯化铁溶液显紫色 | |
| D. | 1molMMF能与2molNaOH溶液完全反应 |
8.利尿剂是2008北京奥运会违禁药物,顾名思义,此类药物有稀释尿液的功能.利尿剂现有15种,主要用于掩盖或“清洗”体内其它违禁药品的存在,以逃避兴奋剂检查.利尿酸是其中之一,其结构简式为:
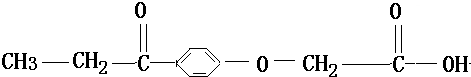
下列叙述正确的是( )
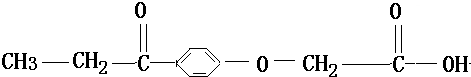
下列叙述正确的是( )
| A. | 1mol利尿酸最多可与5molH2发生加成反应 | |
| B. | 利尿酸分子中位于同一平面内的原子有10个 | |
| C. | 利尿酸分子式是C11H12O4 | |
| D. | 利尿酸与新制Cu(OH)2悬浊液反应有红色沉淀生成 |
5.下列说法正确的是( )
| A. | 海水提溴的过程中不发生氧化还原反应 | |
| B. | 铁的冶炼过程是利用置换反应得到单质铁 | |
| C. | 石油分馏是物理变化,可得到汽油、煤油和柴油等 | |
| D. | CO2、NO2或者SO2都会导致酸雨的形成 |
12.己知维生素A的结构简式,关于它的说法正确的是( )


| A. | 维生素A是一种不溶于水的物质 | |
| B. | 维生素A的1个分子中有3个碳碳双键 | |
| C. | 维生素A的1个分子中有20个氢原子 | |
| D. | 维生素A具有苯环的结构单元 |
10.下列说法中正确的是( )
| A. | 离子组K+、Fe2+、NO3-、I-因发生氧化还原反应而不能大量共存 | |
| B. | 离子组K+、Na+、ClO-、Cl-中加入稀硫酸后还能够大量共存 | |
| C. | 过量SO2通入氨水的反应为SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| D. | Na2CO3溶液显碱性的原因主要是CO32-+H20?HCO3-+OH- |