题目内容
【题目】研究NOx、CO等大气污染气体的处理及利用的方法具有重要意义,可实现绿色环保、节能减排、废物利用等目的。
(1) 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
(3) 用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
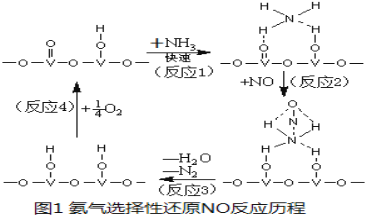
①写出总反应化学方程式 。
②测得该反应的平衡常数与温度的关系为:lgK=5.08+217.5/T,该反应是 反应(填“吸热”或“放热”)。
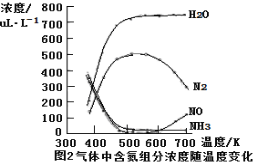
③该反应的含氮气体组分随温度变化如图2所示,当温度达到700K时,发生副反应的化学方程式 。
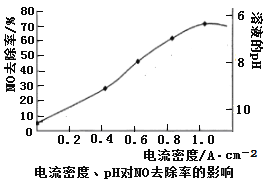
(4)下图是用食盐水做电解液电解烟气脱氮的一种原理图,NO被阳极产生的氧化性物质氧化为NO3—,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。
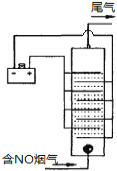
①NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式 。
②溶液的pH对NO去除率影响的原因是 。
③若极板面积10cm2,实验烟气含NO 1.5%,流速为0.070L·s-1(气体体积已折算成标准状态,且烟气中无其他气体被氧化),法拉第常数为96500 C·mol-1,测得电流密度为1.0 A·cm-2。列式计算实验中NO除去率 。
【答案】(1) CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJ·mol-1(2分)
(2) 75%(2分) (3) ①4NH3+4NO+O2![]() 4N2+6H2O (2分) ② 放热 (1分)
4N2+6H2O (2分) ② 放热 (1分)
③4NH3+5O2 ![]() 4NO+6H2O;(2分)(4) ①3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O(2分)
4NO+6H2O;(2分)(4) ①3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O(2分)
②次氯酸钠在酸性条件下氧化性增强(1分)③ (2分)
(2分)
【解析】
试题分析:(1)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
根据盖斯定律可知(①+②)÷2即得到甲烷直接将NO2还原为N2的热化学方程式为
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJ·mol-1。
(2) CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 0.02 0.02 0 0
转化浓度(mol/L) c c c c
平衡浓度(mol/L)0.02-c 0.02-c c c
则根据平衡常数可知![]()
解得c=0.015
所以CO的转化率是![]() ×100%=75%
×100%=75%
(3)①用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2![]() 4N2+6H2O。
4N2+6H2O。
②测得该反应的平衡常数与温度的关系为:lgK=5.08+217.5/T,这说明升高温度K值减小,因此反应向逆反应方向进行,所以该反应是放热反应。
③根据图像可知当温度达到700K时氮气的含量降低,NO含量升高,这说明氨气被氧气氧化为NO和水,则发生副反应的化学方程式为4NH3+5O2 ![]() 4NO+6H2O。
4NO+6H2O。
(4)①惰性电极电解饱和食盐水,阳极氯离子放电产生氯气,则NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式为3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O。
②根据图像可知pH越小,去除率越高,这是由于次氯酸钠在酸性条件下氧化性增强,因此去除率升高。
③若极板面积10cm2,实验烟气含NO 1.5%,流速为0.070L·s-1(气体体积已折算成标准状态,且烟气中无其他气体被氧化),法拉第常数为96500 C·mol-1,测得电流密度为1.0 A·cm-2,反应中氮元素化合价从+2价升高到+5价,失去3个电子,因此实验中NO除去率为 。
。

 名校课堂系列答案
名校课堂系列答案