题目内容
1.下表列出了①~⑥六种元素在元素周期表中的位置.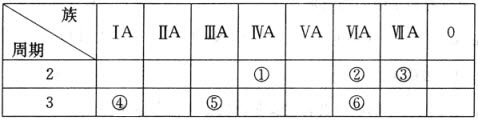
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是F(填写元素符号);
(2)元素⑥的氢化物的分子式是H2S;
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
分析 由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S,
(1)同周期自左而右元素非金属性增强;
(2)⑥为S元素,最低负化合价为-2,据此书写氢化物化学式;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S,
(1)①、②、③同周期,原子序数依次增大,自左而右元素非金属性增强,故F元素非金属性最强,故答案为:F;
(2)⑥为S元素,最低负化合价为-2,其氢化物化学式为H2S,故答案为:H2S;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查了元素周期表和元素周期律的综合应用,根据元素在周期表中的位置确定元素,再结合元素周期律来分析解答,熟练掌握元素周期律内涵及外延,灵活运用元素周期律解答问题,题目难度不大.

练习册系列答案
相关题目
12.常温下,下列对于溶液问题的叙述正确的是( )
| A. | pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH=5 | |
| B. | pH=3的盐酸与pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO两种溶液中水的电离程度相同 |
9.实验室中可用KMnO4来制取氧气.KMnO4中锰元素的化合价为( )
| A. | +7 | B. | +5 | C. | +3 | D. | -7 |
16.下列有关化学反应速率与化学反应限度的叙述中,错误的是( )
| A. | 化学反应速率是表示化学反应快慢的物理量 | |
| B. | 一般情况下,升高温度能加快化学反应速率 | |
| C. | 可逆反应达到化学反应限度时,反应就静止不动了 | |
| D. | 可逆反应达到化学反应限度时,正反应速率等于逆反应速率 |
6.设NA代表阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 将CO2通过Na2O2使其增重a g时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 常温常压下,3.0 g 含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24L的CH4中含有的C-H键数为0.4NA |
13.(1)室温时纯水中 c(H+)=c(OH-),向纯水中加入少量下列固体物质:
A、NaOH B、Na2SO4 C、NH4Cl
试回答如下问题:
Ⅰ.溶液中H+、OH-浓度变化情况(填“增大”、“减少”、“不变”);
Ⅱ.c(H+)与 c(OH-)大小比较(填“>”、“<”、“=”);
Ⅲ.溶液的酸碱性(填“酸性”、“碱性”、“中性”);
请按上述要求补充完整表中相关内容:
(2)已知25℃合成氨反应中,1molN2完全转化为NH3时释放的能量为92.4kJ.现将1molN2和3molH2混全置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol.试回答:
①该反应的热化学方方程式为N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②该反应达到平衡后,升高温度平衡向逆 (填“正”、“逆”)反应方向移动;增大压强平衡向正 (填“正”、“逆”)反应方向移动;加入催化剂平衡不能(填“能”、“不能”)移动;
③前2s内v(H2)为0.15mol/(L•s).
A、NaOH B、Na2SO4 C、NH4Cl
试回答如下问题:
Ⅰ.溶液中H+、OH-浓度变化情况(填“增大”、“减少”、“不变”);
Ⅱ.c(H+)与 c(OH-)大小比较(填“>”、“<”、“=”);
Ⅲ.溶液的酸碱性(填“酸性”、“碱性”、“中性”);
请按上述要求补充完整表中相关内容:
| A、NaOH | B、Na2SO4 | C、NH4Cl | |
| c(H+) | 减小 | ① | 增 大 |
| c(OH-) | ② | 不 变 | ③ |
| c(H+)与c(OH-)的大小比较 | ④ | = | > |
| 溶液的酸碱性 | 碱 性 | ⑤ | 酸 性 |
①该反应的热化学方方程式为N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②该反应达到平衡后,升高温度平衡向逆 (填“正”、“逆”)反应方向移动;增大压强平衡向正 (填“正”、“逆”)反应方向移动;加入催化剂平衡不能(填“能”、“不能”)移动;
③前2s内v(H2)为0.15mol/(L•s).
11.某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.
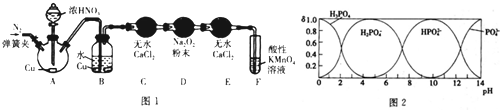
查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
则该温度下相同pH的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的物质的量浓度由大到小的顺序为a>d>b>c(填编号).
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.

查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
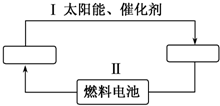 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).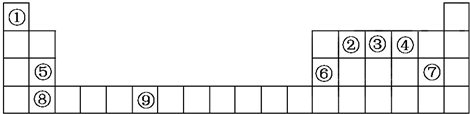
 .
.