题目内容
10.下表为元素周期表的一部分.请回答下列问题: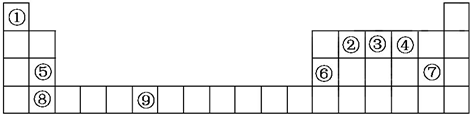
(1)上述元素中,属于s区的是H、Mg、Ca (填元素符号).
(2)写出元素⑨的基态原子的价电子排布图
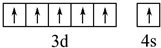 .
.(3)元素的第一电离能:③大于④(选填“大于”或“小于”).
(4)元素③气态氢化物的VSEPR模型为四面体;该分子为极性分子(选填“极性”或“非极性”).向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为先产生蓝色沉淀,后溶解得深蓝色溶液.
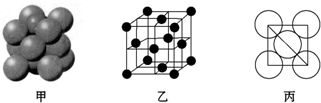
(5)元素⑥的单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为12,该晶体的密度为$\frac{\sqrt{2}M}{8{N}_{A}}$(用字母表示).
分析 根据元素在周期表中的位置知,①~⑨分别是H、C、N、O、Mg、Al、Cl、Ca、Cr元素,
(1)上述元素中,属于s区的元素位于第I、IIA族;
(2)元素⑨是Cr元素,其基态原子价电子为3d、4s能级上电子,3d、4s能级上分别含有5、1个电子;
(3)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素;
(4)元素③气态氢化物是氨气,氨气分子中N原子价层电子对个数是4,且含有一个孤电子对,根据价层电子对互斥理论判断其VSEPR模型;正负电荷重心重合的分子是非极性分子,不重合的分子是极性分子;
硫酸铜和一水合氨反应生成氢氧化铜蓝色沉淀,当氨水过量时,氢氧化铜和一水合氨反应生成铜氨络合物;
(5)根据晶胞结构知,该原子配位数=3×8÷2;晶胞棱长=$\frac{\sqrt{2}}{2}×4dcm$=2$\sqrt{2}$dcm,晶胞体积=(2$\sqrt{2}$dcm)3,该晶胞中原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:根据元素在周期表中的位置知,①~⑨分别是H、C、N、O、Mg、Al、Cl、Ca、Cr元素,
(1)上述元素中,属于s区的元素位于第I、IIA族,所以位于s区的元素是H、Mg、Ca,故答案为:H、Mg、Ca;
(2)元素⑨是Cr元素,其基态原子价电子为3d、4s能级上电子,3d、4s能级上分别含有5、1个电子,所以其价电子排布图为 ,
,
故答案为: ;
;
(3)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能N>O,故答案为:大于;
(4)元素③气态氢化物是氨气,氨气分子中N原子价层电子对个数是4,且含有一个孤电子对,根据价层电子对互斥理论判断其VSEPR模型为四面体形;正负电荷重心重合的分子是非极性分子,不重合的分子是极性分子,氨气分子正负电荷重心不重合,为极性分子;
硫酸铜和一水合氨反应生成氢氧化铜蓝色沉淀,当氨水过量时,氢氧化铜和一水合氨反应生成铜氨络合物,所以看到的现象是先产生蓝色沉淀,后溶解得深蓝色溶液,
故答案为:四面体;极性;先产生蓝色沉淀,后溶解得深蓝色溶液;
(5)根据晶胞结构知,该原子配位数=3×8÷2=12;晶胞棱长=$\frac{\sqrt{2}}{2}×4dcm$=2$\sqrt{2}$dcm,晶胞体积=(2$\sqrt{2}$dcm)3,该晶胞中原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}d)^{3}}$=$\frac{\sqrt{2}M}{8{N}_{A}}$,
故答案为:12;$\frac{\sqrt{2}M}{8{N}_{A}}$.
点评 本题考查物质结构和性质,侧重考查学生分析计算及空间想象能力,涉及晶胞计算、配合物、分子空间构型、原子核外电子排布、电离能等知识点,这些知识点都是高频考点,难点是晶胞及配位数的计算.

| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | A极上有红色固体析出 | 不能说明锌的金属性比铜强 |
| A. |  | B. | 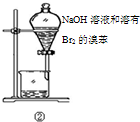 | C. | 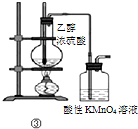 | D. | 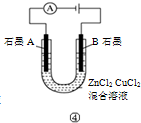 |
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,$\frac{{cCH}_{3}COOH}{{cH}^{+}}$变小 | |
| C. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-) | |
| D. | 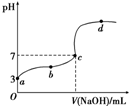 向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL 向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL |
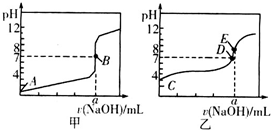 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )| A. | 滴定盐酸的曲线是图乙 | |
| B. | 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X-) | |
| C. | 达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X-)>c(Na+)>c(H+)>c(OH-) |
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 将氯化铁饱和溶液煮沸,以制取氢氧化铁胶体 | |
| C. | 某无色溶液中加入足量稀盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则原溶液中一定含有SO42- | |
| D. | 用无锈铁丝蘸取某溶液在酒精灯上灼烧,火焰呈黄色,则说明该溶液中一定不含钾离子 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)在这些元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式)
(3)在这些元素中,原子半径最大的是Na(填元素符号)

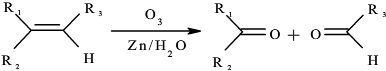
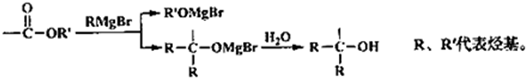
 →
→ +2CH3OMgBr.
+2CH3OMgBr.