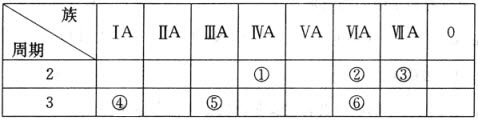
题目内容
13.(1)室温时纯水中 c(H+)=c(OH-),向纯水中加入少量下列固体物质:A、NaOH B、Na2SO4 C、NH4Cl
试回答如下问题:
Ⅰ.溶液中H+、OH-浓度变化情况(填“增大”、“减少”、“不变”);
Ⅱ.c(H+)与 c(OH-)大小比较(填“>”、“<”、“=”);
Ⅲ.溶液的酸碱性(填“酸性”、“碱性”、“中性”);
请按上述要求补充完整表中相关内容:
| A、NaOH | B、Na2SO4 | C、NH4Cl | |
| c(H+) | 减小 | ① | 增 大 |
| c(OH-) | ② | 不 变 | ③ |
| c(H+)与c(OH-)的大小比较 | ④ | = | > |
| 溶液的酸碱性 | 碱 性 | ⑤ | 酸 性 |
①该反应的热化学方方程式为N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②该反应达到平衡后,升高温度平衡向逆 (填“正”、“逆”)反应方向移动;增大压强平衡向正 (填“正”、“逆”)反应方向移动;加入催化剂平衡不能(填“能”、“不能”)移动;
③前2s内v(H2)为0.15mol/(L•s).
分析 (1)室温时纯水中 c(H+)=c(OH-),加入NaOH固体后,导致c(OH-)增大,水的电离平衡发生移动,引起c(H+)的改变;
加入Na2SO4固体后,由于Na2SO4是强碱强酸的正盐,水的电离平衡没被破坏,由此分析c(H+)和溶液酸碱性;
加入NH4Cl固体后,由于NH4Cl是强酸弱碱盐,能结合水电离出的OH-,据此分析溶液中c(OH-)的改变;
(2)①书写热化学方程式时,反应热与反应物的物质的量成比例,且要标注物质的聚集状态;
②升高温度,平衡向着吸热反应方向移动;增大压强,平衡向着气体体积减小的方向移动;使用催化剂,平衡不移动;
③先求出V(NH3)=$\frac{\frac{n(N{H}_{3})}{V}}{△t}$,然后根据反应速率之比等于计量数之比来计算.
解答 解:(1)室温时纯水中 c(H+)=c(OH-)=10-7mol/L.
加入NaOH固体后,导致c(OH-)增大,水的电离平衡左移,导致c(H+)减小,故有c(H+)<c(OH-),故②为增大,④为<;
加入Na2SO4固体后,由于Na2SO4是强碱强酸的正盐,水的电离平衡没被破坏,故溶液中的c(H+)和c(OH-)均不变,溶液呈中性,即①不变,⑤呈中性;
加入NH4Cl固体后,由于NH4Cl是强酸弱碱盐,能结合水电离出的OH-,导致溶液中c(OH-)变小,故③为减少;
故答案为:①不变; ②增大; ③减少; ④<;⑤中性;
(2)①书写热化学方程式时,反应热与反应物的物质的量成比例,且要标注物质的聚集状态,由于1molN2完全转化为NH3时释放的能量为92.4kJ,故热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,故答案为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol;
②由于此反应为放热反应,故升高温度,平衡向着吸热反应方向移动即向逆反应方向移动;此反应正反应方向是气体体积减小的反应,而增大压强,平衡向着气体体积减小的方向移动即向正反应方向移动;使用催化剂,平衡不移动,故答案为:逆,正,不能;
③由于反应进行到2s末测得NH3为0.4mol,故V(NH3)=$\frac{\frac{n(N{H}_{3})}{V}}{△t}$=$\frac{\frac{0.4mol}{2L}}{2s}$=0.1mol/(L•s),而一个反应中各物质的反应速率之比等于计量数之比,故有:
V(H2)=$\frac{V(N{H}_{3})}{2}×3$=0.15 mol/(L•s),故答案为:0.15 mol/(L•s).
点评 本题考查了外界条件对水的电离平衡的影响、热化学方程式的书写以及平衡的移动,难度不大,注意基础的把握.

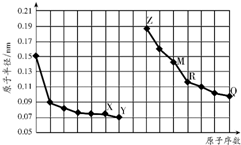
| A. | R在周期表的第14列 | |
| B. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
| 化学式 | 电离常数 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | A极上有红色固体析出 | 不能说明锌的金属性比铜强 |
| A. |  | B. | 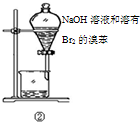 | C. | 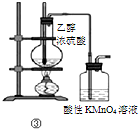 | D. |  |
 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )| A. | 滴定盐酸的曲线是图乙 | |
| B. | 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X-) | |
| C. | 达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X-)>c(Na+)>c(H+)>c(OH-) |
| A. | 1.6a g | B. | (a-3.2)g | C. | (a-1.6)g | D. | 1.6 g |
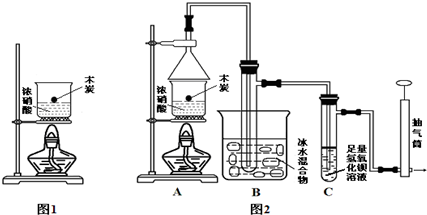
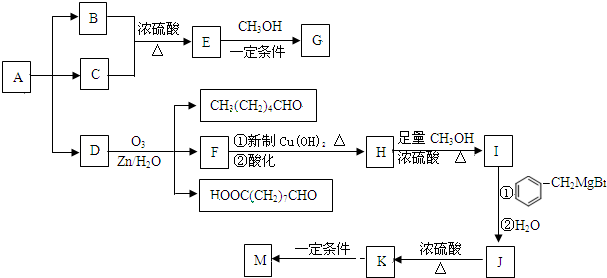
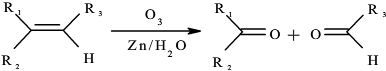
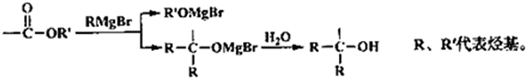
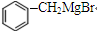 →
→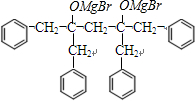 +2CH3OMgBr.
+2CH3OMgBr.