题目内容
11.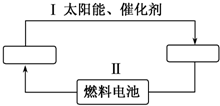 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).(1)从能量转换的角度看,过程Ⅱ上应是化学能转化为电能.
(2)过程Ⅱ的完成可以在不同的电解质溶液中进行,试分别写出符合下列要求的电极反应式:
①以稀硫酸为电解质:正极:O2+4H++4e-═2H2O.
②以氢氧化钠溶液为电解质:负极:H2-2e-+2OH-=2H2O.
③当电解质为熔融ZrO2(掺杂有Y2O3)的晶体(在高温下电离,以金属阳离子和O2-导电)时,正极:O2+4e-=2O2-,负极:H2-2e-+O2-=H2O.
分析 分析转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气;
(1)过程Ⅱ是发生的原电池反应;
(2)氢氧燃料电池工作时,氢气失电子生成水;氧气得电子生成氢氧根离子;氢氧燃料电池的产物为水,依据不同电解质环境判断生成产物,结合电荷守恒书写电极反应;
解答 解:转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气,两个框中为循环过程中反应物和生成物的分子式为:左为H2O;右为H2、O2;
故答案为:H2O;H2、O2;
(1)过程Ⅱ是发生的原电池反应,能量变化是化学能转化为电能的过程;
故答案为:化学;电;
(2)氢氧燃料电池工作时,氢气失电子是还原剂,发生氧化反应;氧气得电子是氧化剂,发生还原反应.
①以稀硫酸为电解质,正极上是O2得到电子在酸溶液中生成水,正极的电极反应式为:O2+4H++4e-═2H2O,
故答案为:O2+4H++4e-═2H2O;
②电解质溶液是KOH溶液(碱性电解质),正极是O2得到电子,正极的电极反应式为:O2+H2O+4e-═4OH-,负极发生的反应为:H2-2e-+2OH-═2H2O;
故答案为:H2-2e-+2OH-=2H2O;
③当电解质为熔融ZrO2(掺杂有Y2O3)的晶体(在高温下电离,以金属阳离子和O2-导电)时,正极电极反应是氧气得到电子生成氧离子,电极反应为:O2+4e-=2O2-,负极是氢气失电子生成水,电极反应为:H2-2e-+O2-=H2O;
故答案为:O2+4e-=2O2-,H2-2e-+O2-=H2O;
点评 本题考查了化学反应过程中能量变化形式,原电池原理的分析应用,注意知识积累,题目难度中等.

| A. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 除去乙烷中混有的乙烯的方法是通氢气在一定条件下反应,使乙烯转化为乙烷 |
| A. | 阳极材料也可以是Cu | |
| B. | 阴极每产生3molH2,则有1mol Cr2O72-被还原 | |
| C. | 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |
| A. | A-x+n+48 | B. | A-x-n-24 | C. | A-x+n+24 | D. | A+x-n-24 |
| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
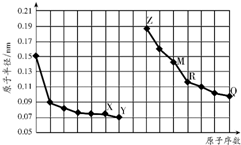
| A. | R在周期表的第14列 | |
| B. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |