题目内容
11.某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.
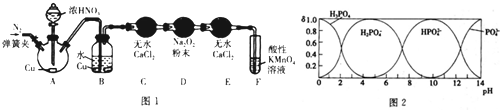
查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
分析 (1)①Cu与浓硝酸反应生成硝酸铜、二氧化氮和水;B中二氧化氮与水反应生成硝酸,Cu与稀硝酸反应生成硝酸铜、NO和水;NO属于有毒气体,要进行尾气处理;
②装置中空气能与NO反应,实验前要排尽;
③根据题中信息可知,D装置中产物为NaNO2,NaNO2与硫酸反应会生成NO;
(2)弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大;
(3)①磷酸钠中钠离子不水解、磷酸根离子水解;向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中HPO42-浓度减小、H2PO4- 浓度增大;
②NaH2PO4溶液钠离子不水解、H2PO4- 水解和电离,溶液呈酸性,溶液中存在电荷守恒和物料守恒;
③Kh═$\frac{c(HP{{O}_{4}}^{2-}).c(O{H}^{-})}{c(P{{O}_{4}}^{3-})}$.
解答 解:(1)①Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,其反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;B中二氧化氮与水反应生成硝酸,Cu与稀硝酸反应生成硝酸铜、NO和水,所以溶液变蓝色,同时生成无色气体;NO能与MnO4-反应生成NO3-和Mn2+,则F装置的作用是吸收未反应的NO;
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;吸收未反应的NO;
②装置中空气能与NO反应,实验前要排尽,通入氮气能起到该作用,即将装置中的空气排净;
故答案为:将装置中的空气排净;
③根据题中信息可知,D装置中产物为NaNO2,NaNO2与硫酸反应会生成NO,要检验NaNO2,先取D装置中是产物少许于试管中,然后加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠;
故答案为:取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠;
(2)弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,pH相同时,盐的水解程度越大,其浓度越小,则浓度:CH3COONa>NaHCO3>NaCN>Na2CO3,则a>d>b>c;
故答案为:a>d>b>c;
(3)①磷酸钠中钠离子不水解、磷酸根离子水解,所以$\frac{c(N{a}^{+})}{c(P{{O}_{4}}^{3-})}$>3;向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中HPO42-浓度减小、H2PO4- 浓度增大,所以发生的反应为 HPO42-+H+═H2PO4-,
故答案为:>;HPO42-+H+═H2PO4-;
②A、钠离子不水解,浓度最大,H2PO4-电离程度大于水解程度,溶液呈酸性,电离程度和水解程度都较小,所以溶液中存在C(Na+)>C(H2PO4-)>C(H+)>C(HPO42-)>C(H3PO4),故A正确;
B、H2PO4-电离程度大于水解程度,所以C(HPO42-)>C(H3PO4),故B错误;
C、溶液中存在电荷守恒C(H+)+C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-),故C错误;
D、溶液中存在物料守恒C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4),故D正确;
故选AD;
③PO43-+H2O?HPO42-+OH-
起始浓度(mol•L-1):0.1 0 0
变化浓度(mol•L-1):0.01 0.01 0.01
平衡浓度(mol•L-1):0.09 0.01 0.01
Kh═$\frac{c(HP{{O}_{4}}^{2-}).c(O{H}^{-})}{c(P{{O}_{4}}^{3-})}$=$\frac{0.01×0.01}{0.09}$=1.1×10 -3mol•L-1 ,
故答案为:1.1×10-3.
点评 本题考查了性质方案设计、弱电解质的电离、盐类水解,根据溶液中的溶质及其溶液酸碱性来分析解答,根据电荷守恒、物料守恒确定离子浓度大小,难点是水解平衡常数的计算,利用三段式法解答,题目难度中等.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )| A. | 滴定盐酸的曲线是图乙 | |
| B. | 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X-) | |
| C. | 达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X-)>c(Na+)>c(H+)>c(OH-) |
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 将氯化铁饱和溶液煮沸,以制取氢氧化铁胶体 | |
| C. | 某无色溶液中加入足量稀盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则原溶液中一定含有SO42- | |
| D. | 用无锈铁丝蘸取某溶液在酒精灯上灼烧,火焰呈黄色,则说明该溶液中一定不含钾离子 |
| A. | 氨气液化以及液氨气化要吸热,所以氨常用于制冷剂 | |
| B. | 做红烧鱼时,常加一些食醋和料酒会更香,是因为生成少量的酯 | |
| C. | “地沟油”经过加工处理后可以用来制肥皂 | |
| D. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
| A. | 将5mL0.02mol/L的H2SO4溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 | |
| B. | 将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合,混合液pH大于7,则反应后的混合液中:c(OH-)+c(A-)>c(H+)+c(HA) | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | 常温下,0.1mol/L的CH3COONa和NaClO的混合溶液中:c(OH-)-c(H+)=c(HClO)+c(CH3COOH) |
| A. | 1.6a g | B. | (a-3.2)g | C. | (a-1.6)g | D. | 1.6 g |
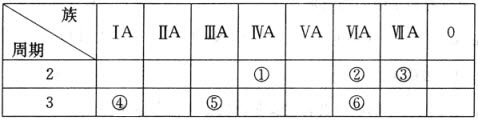
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)在这些元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式)
(3)在这些元素中,原子半径最大的是Na(填元素符号)