题目内容
18. 丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.(1)已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H=-2 741.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
则反应C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)的△H=-2219.9 kJ•mol-1.
(2)某课外活动小组为了探究在相同温度下反应过程中能量变化与化学平衡的关系,将C3H8不完全燃烧的产物CO和H2O(g),通入到体积均为1L的A、B两个密闭容器中,在相同温度下均发生如下可逆反应:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
相关数据如下:
| 容器 编号 | 起始时各物质 的物质的量/mol | 达到平衡 的时间/min | 达到平衡时 体系能量的 变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | 放出热量:36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | 放出热量:Q |
①0~ta时刻,容器A中CO的平均反应速率为$\frac{0.9}{{t}_{a}}$ mol•L-1•min-1,化学平衡常数Ka=1.35;若容器B中反应的平衡常数为Kb,则该温度下Ka等于(填“大于”“小于”或“等于”)Kb.
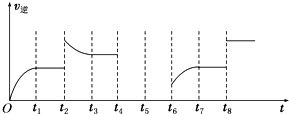
②某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:通过研究图象发现,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,它们改变的条件分别是t2升高温度(或增大CO2的浓度或增大H2的浓度),t8使用催化剂或加压(减小容器的体积).
③测得在容器A中反应进行到t min时,混合气体中CO2的物质的量为0.3mol,若用150mL 3mol•L-1的NaOH溶液将其完全吸收,则所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)CO2溶于水生成H2CO3,已知:常温下,H2CO3和HClO的电离常数如下:
H2CO3?H++HCO${\;}_{3}^{-}$ Ka1=4.2×10-7 mol•L-1
HCO${\;}_{3}^{-}$?H++CO${\;}_{3}^{2-}$ Ka2=5.6×10-11 mol•L-1
HClO?H++ClO- Ka=4.7×10-8 mol•L-1
请写出氯气和碳酸钠在物质的量之比为1:1时发生反应的离子方程式:Cl2+CO32-+H2O═Cl-+HClO+HCO3-.
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式,反应热也处于相应的系数进行相应的加减,据此计算△H;
(2)①根据公式v=$\frac{△c}{△t}$计算求解,化学平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,平衡常数是温度的函数;
②在t2时刻,v逆突然增大且平衡逆向移动,故可能的原因是升高反应温度或增加产物CO2或H2的浓度等;t8时刻v逆突然增大但原平衡没有移动,故改变的条件是使用催化剂或加压,缩小容器体积;
③反应后所得溶液中溶质为等物质的量的Na2CO3和NaHCO3,碳酸钠的水解程度大于碳酸氢钠的水解程度,所以碳酸氢根离子的浓度大于碳酸根离子的浓度,由此分析解答;
(3)利用电离常数可知酸性:H2CO3>HClO>HCO3-,然后应用强酸制弱酸,而氯气与Na2CO3以物质的量1:1进行反应时的反应原理为氯气与水反应生成的HCl与Na2CO3作用生成NaHCO3与NaCl,由此分析解答.
解答 解:(1)已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l)△H1=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
根据盖斯定律,①+②×3得2C3H8(g)+10O2(g)=6CO2(g)+8H2O(l),△H3=-2741.8kJ/mol+(-566kJ/mol)×3=-4439.8kJ/mol,
即C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2219.9kJ/mol,
故答案为:-2219.9;
(2)①利用热化学方程式可知,放出36.9 kJ的热量时消耗n(CO)=$\frac{36.9}{41}$=0.9 mol,故0~ta,容器A中v(CO)=$\frac{0.9}{1×{t}_{a}}$=$\frac{0.9}{{t}_{a}}$ mol•L-1•min-1;化学平衡常数Ka=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.9×0.9}{0.6×1.0}$=1.35;因A、B容器反应温度相同,故反应的平衡常数相等,
故答案为:$\frac{0.9}{{t}_{a}}$;1.35;等于;
②在t2时刻,v逆突然增大且平衡逆向移动,故可能的原因是升高反应温度或增加产物CO2或H2的浓度等;t8时刻v逆突然增大但原平衡没有移动,故改变的条件是使用催化剂或加压,缩小容器体积,
故答案为:升高温度(或增大CO2的浓度或增大H2的浓度);使用催化剂或加压(减小容器的体积);
③反应后所得溶液中溶质为等物质的量的Na2CO3和NaHCO3,溶液中Na+浓度最大,因CO32-水解程度大于HCO3-,引起c(CO32-)<c(HCO3-)且溶液呈碱性,所以离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)利用电离常数可知酸性:H2CO3>HClO>HCO3-,故氯气与Na2CO3以物质的量1:1进行反应时的反应原理为氯气与水反应生成的HCl与Na2CO3作用生成NaHCO3与NaCl,HClO与NaHCO3不能发生反应,故反应的离子方程式为Cl2+CO32-+H2O═Cl-+HClO+HCO3-,故答案为:Cl2+CO32-+H2O═Cl-+HClO+HCO3-.
点评 本题考查盖斯定律的应用、求化学反应速率、化学平衡常数、影响化学平衡常数的影响因素和离子浓度大小的比较,综合性强,有一定的难度.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| 反应时间/min | n(CH3OH)/mol | n(CH3OCH3)/mo |
| 0 | 2.05 | 0 |
| t1 | 0.6 | |
| t2 | 0.05 |
| A. | 反应在t2 min时v正≠v逆 | |
| B. | 反应达到平衡时,放出的热量为50 kJ | |
| C. | 反应在t1 min内的平均速率为v(CH3OH)=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1 | |
| D. | 若反应达到平衡后,缩小容器体积,$\frac{c(C{H}_{3}OC{H}_{3})}{c(C{H}_{3}OH)}$变大 |
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法判断 |
 室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的( )
室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的( )| A. | I曲线表示的是滴定盐酸的曲线 | |
| B. | x=20 | |
| C. | 滴定过程中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值逐渐减小 | |
| D. | 当I曲线和II曲线pH均为7时,一溶液中的c(Cl-)等于另一溶液中的c(CH3COO-) |
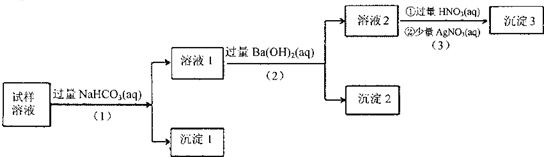
已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 沉淀2放置在空气中,若质量增加,试样中肯定存在SO32- | |
| B. | 试样溶液中加人稍过量的NH4C1溶液能得到与沉淀1成分相同的物质 | |
| C. | 上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 | |
| D. | 试样溶液中肯定存在A102-、Cl-,其中Na+、K+至少存在1种 |
| 弱酸 | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54×10-2 | 2.95×10-8 | 4.30×10-7 |
| Ka2 | 1.02×10-7 | - | 5.61×10-11 |
| A. | NaClO溶液中通入少量CO2:ClO-+H2O+CO2═HCO3-+HClO | |
| B. | 氯水中加入少量NaCO3粉末:HCO3-+H+═H2O+CO2↑ | |
| C. | NaClO溶液中通入少量SO2:2ClO-+H2O+SO2═SO32-+2HClO | |
| D. | Na2CO2溶液中缓慢通入少量SO2:2CO32-+H2O+SO2═SO32-+2HCO3- |


 第Ⅵ族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第Ⅵ族元素的化合物在研究和生产中有许多重要用途,请回答下列问题.
第Ⅵ族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第Ⅵ族元素的化合物在研究和生产中有许多重要用途,请回答下列问题.