题目内容
1.某温度下,向体积为2L的密闭容器中加入CH3OH,发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,反应过程中测定的部分数据见下表.已知该温度下反应的平衡常数K=400,下列说法正确的是( )| 反应时间/min | n(CH3OH)/mol | n(CH3OCH3)/mo |
| 0 | 2.05 | 0 |
| t1 | 0.6 | |
| t2 | 0.05 |
| A. | 反应在t2 min时v正≠v逆 | |
| B. | 反应达到平衡时,放出的热量为50 kJ | |
| C. | 反应在t1 min内的平均速率为v(CH3OH)=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1 | |
| D. | 若反应达到平衡后,缩小容器体积,$\frac{c(C{H}_{3}OC{H}_{3})}{c(C{H}_{3}OH)}$变大 |
分析 A.计算反应在t2 min时的浓度商,与平衡常数进行比较回答;
B.根据平衡常数进行计算生成CH3OCH3的物质的量,进而计算放出的热量;
C.根据v=$\frac{△c}{△t}$进行计算;
D.反应前后气体的体积保持不变,故改变压强对平衡无影响.
解答 解:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,
A.反应在t2 min时,CH3OH的物质的量浓度为$\frac{0.05mol}{2L}$=0.025mol/L,参加反应的CH3OH的物质的量浓度为$\frac{2.05-0.05}{2}$=1mol/L,故CH3OCH3的物质的量浓度为$\frac{1mol/L}{2}$=0.5mol/L,H2O的物质的量浓度为0.5mol/L,故Qc=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.5×0.5}{0.025×0.025}$=400=K,故v正=v逆,故A错误;
B.令平衡后c(CH3OCH3)=xmol/L,根据方程式可知平衡时c(CH3OH)=($\frac{2.05}{2}$-2x)=(1.025-2x)mol/L,c(H2O)=xmol/L,平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x×x}{(1.025-2x)^{2}}$=400,解得x=0.5,则放出的热量为0.5mol/L×2L×25kJ•mol-1=25kJ,故B错误;
C.反应在t1 min内,生成CH3OH的物质的量为0.6×2=1.2mol,故v(CH3OH)=$\frac{\frac{1.2mol}{2L}}{{t}_{1min}}$=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1,故C正确;
D.缩小容器体积,压强增大,平衡不发生移动,故$\frac{c(C{H}_{3}OC{H}_{3})}{c(C{H}_{3}OH)}$保持不变,故D错误;
故选C.
点评 本题考查化学平衡常数的有关计算与影响因素、化学平衡移动、化学反应中能量变化等,难度中等,根据化学平衡常数进行计算、判断反应进行方向是考查的趋势.

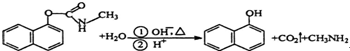
| A. | 西维因是一种芳香烃 | |
| B. | 西维因分子中所有碳原子一定共面 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化加热条件下西维因不能与H2加成 |
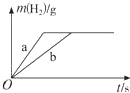
| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑧ | ⑨ | ⑩ |
(2)在 ①~⑩元素的最高价氧化物的水化物呈两性的是Al(OH)3;⑥形成的最高价氧化物的水化物的分子式是HClO4;
(3)①形成的气态氢化物的结构式是
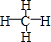 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体. | A. | D2O | B. | NH3 | C. | Cl2 | D. | NaCl |
 丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.(1)已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H=-2 741.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
则反应C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)的△H=-2219.9 kJ•mol-1.
(2)某课外活动小组为了探究在相同温度下反应过程中能量变化与化学平衡的关系,将C3H8不完全燃烧的产物CO和H2O(g),通入到体积均为1L的A、B两个密闭容器中,在相同温度下均发生如下可逆反应:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
相关数据如下:
| 容器 编号 | 起始时各物质 的物质的量/mol | 达到平衡 的时间/min | 达到平衡时 体系能量的 变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | 放出热量:36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | 放出热量:Q |
①0~ta时刻,容器A中CO的平均反应速率为$\frac{0.9}{{t}_{a}}$ mol•L-1•min-1,化学平衡常数Ka=1.35;若容器B中反应的平衡常数为Kb,则该温度下Ka等于(填“大于”“小于”或“等于”)Kb.
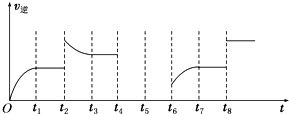
②某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:通过研究图象发现,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,它们改变的条件分别是t2升高温度(或增大CO2的浓度或增大H2的浓度),t8使用催化剂或加压(减小容器的体积).
③测得在容器A中反应进行到t min时,混合气体中CO2的物质的量为0.3mol,若用150mL 3mol•L-1的NaOH溶液将其完全吸收,则所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)CO2溶于水生成H2CO3,已知:常温下,H2CO3和HClO的电离常数如下:
H2CO3?H++HCO${\;}_{3}^{-}$ Ka1=4.2×10-7 mol•L-1
HCO${\;}_{3}^{-}$?H++CO${\;}_{3}^{2-}$ Ka2=5.6×10-11 mol•L-1
HClO?H++ClO- Ka=4.7×10-8 mol•L-1
请写出氯气和碳酸钠在物质的量之比为1:1时发生反应的离子方程式:Cl2+CO32-+H2O═Cl-+HClO+HCO3-.