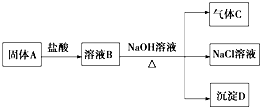
题目内容
6.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图装置进行有关实验.请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)装置B可作储气之用,称之为储气瓶,B中广口瓶内应盛放的液体是①(填序号)
①水 ②酸性KMnO4 ③NaHCO3溶液 ④NaOH溶液
(3)装置C中观察到的现象有淡黄色沉淀产生,装置D中观察到的现象品红溶液褪色.
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)B中的液体不能与二氧化硫反应,据此进行分析;
(3)二氧化硫能够与硫化氢反应生成淡黄色的硫单质;二氧化硫具有漂白性,能够使品红溶液褪色.
解答 解:(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)装置B可作储气之用,称之为储气瓶,储存的气体为二氧化硫,所以B中广口瓶内应盛放的液体不能与二氧化硫反应,而②酸性KMnO4、③NaHCO3溶液、④NaOH溶液都与二氧化硫反应,不符合条件,只有①满足条件,
故答案为:①;
(3)装置C中盛有硫化钠,二氧化硫能够与硫化钠溶液反应生成S单质,所以C中有淡黄色沉淀产生;二氧化硫气体具有漂白性,所以装置D中的品红溶液褪色,
故答案为:有淡黄色沉淀产生;品红溶液褪色.
点评 本题考查了浓硫酸的性质,题目难度不大,明确铜与浓硫酸的反应原理及二氧化硫的性质、检验方法即可解答,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
9.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图所示,则下列说法中正确的是( )
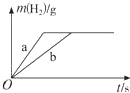

| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
10.下列各化学式中,所有原子(或离子)都满足最外层为8电子结构的化合物是( )
| A. | D2O | B. | NH3 | C. | Cl2 | D. | NaCl |
1.构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,下列能量大小顺序中正确的是( )
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
11.某课外活动小组为探究金属与浓硫酸反应,进行了如下实验.
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图1所示.(固定装置已略去)
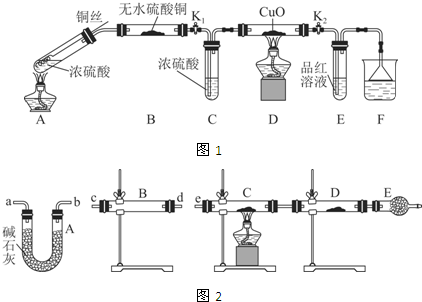
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(2)某同学用下列装置(如图2)连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
①无水硫酸铜②固体由白色变成蓝色③SO2中含有水蒸气④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色⑤SO2中含有氢气.
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图1所示.(固定装置已略去)

(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(2)某同学用下列装置(如图2)连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
18. 丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
(1)已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H=-2 741.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
则反应C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)的△H=-2219.9 kJ•mol-1.
(2)某课外活动小组为了探究在相同温度下反应过程中能量变化与化学平衡的关系,将C3H8不完全燃烧的产物CO和H2O(g),通入到体积均为1L的A、B两个密闭容器中,在相同温度下均发生如下可逆反应:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
相关数据如下:
请回答下列问题:
①0~ta时刻,容器A中CO的平均反应速率为$\frac{0.9}{{t}_{a}}$ mol•L-1•min-1,化学平衡常数Ka=1.35;若容器B中反应的平衡常数为Kb,则该温度下Ka等于(填“大于”“小于”或“等于”)Kb.
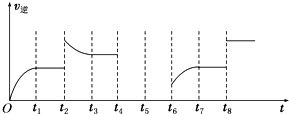
②某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:通过研究图象发现,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,它们改变的条件分别是t2升高温度(或增大CO2的浓度或增大H2的浓度),t8使用催化剂或加压(减小容器的体积).
③测得在容器A中反应进行到t min时,混合气体中CO2的物质的量为0.3mol,若用150mL 3mol•L-1的NaOH溶液将其完全吸收,则所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)CO2溶于水生成H2CO3,已知:常温下,H2CO3和HClO的电离常数如下:
H2CO3?H++HCO${\;}_{3}^{-}$ Ka1=4.2×10-7 mol•L-1
HCO${\;}_{3}^{-}$?H++CO${\;}_{3}^{2-}$ Ka2=5.6×10-11 mol•L-1
HClO?H++ClO- Ka=4.7×10-8 mol•L-1
请写出氯气和碳酸钠在物质的量之比为1:1时发生反应的离子方程式:Cl2+CO32-+H2O═Cl-+HClO+HCO3-.
 丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.(1)已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H=-2 741.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
则反应C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)的△H=-2219.9 kJ•mol-1.
(2)某课外活动小组为了探究在相同温度下反应过程中能量变化与化学平衡的关系,将C3H8不完全燃烧的产物CO和H2O(g),通入到体积均为1L的A、B两个密闭容器中,在相同温度下均发生如下可逆反应:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
相关数据如下:
| 容器 编号 | 起始时各物质 的物质的量/mol | 达到平衡 的时间/min | 达到平衡时 体系能量的 变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | 放出热量:36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | 放出热量:Q |
①0~ta时刻,容器A中CO的平均反应速率为$\frac{0.9}{{t}_{a}}$ mol•L-1•min-1,化学平衡常数Ka=1.35;若容器B中反应的平衡常数为Kb,则该温度下Ka等于(填“大于”“小于”或“等于”)Kb.
②某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:通过研究图象发现,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,它们改变的条件分别是t2升高温度(或增大CO2的浓度或增大H2的浓度),t8使用催化剂或加压(减小容器的体积).
③测得在容器A中反应进行到t min时,混合气体中CO2的物质的量为0.3mol,若用150mL 3mol•L-1的NaOH溶液将其完全吸收,则所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)CO2溶于水生成H2CO3,已知:常温下,H2CO3和HClO的电离常数如下:
H2CO3?H++HCO${\;}_{3}^{-}$ Ka1=4.2×10-7 mol•L-1
HCO${\;}_{3}^{-}$?H++CO${\;}_{3}^{2-}$ Ka2=5.6×10-11 mol•L-1
HClO?H++ClO- Ka=4.7×10-8 mol•L-1
请写出氯气和碳酸钠在物质的量之比为1:1时发生反应的离子方程式:Cl2+CO32-+H2O═Cl-+HClO+HCO3-.
15.分子式为CxHyO2的有机物1mol在氧气中燃烧,产生二氧化碳和水蒸气的体积相等,并耗氧气3.5mol,则该有机物中x、y的值分别为( )
| A. | 1、2 | B. | 2、3 | C. | 3、6 | D. | 4、6 |