题目内容
10.某溶液中可能含有Na+、K+、AlO2-、CO32-、SO32-、Cl-中的若干种离子.某同学设并完成了如下实验: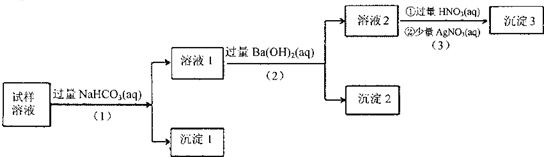
已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 沉淀2放置在空气中,若质量增加,试样中肯定存在SO32- | |
| B. | 试样溶液中加人稍过量的NH4C1溶液能得到与沉淀1成分相同的物质 | |
| C. | 上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 | |
| D. | 试样溶液中肯定存在A102-、Cl-,其中Na+、K+至少存在1种 |
分析 溶液加入过量的溶液后,生成沉淀1,由题意可知原溶液中一定有AlO2-;所得溶液I中加入过量的Ba(OH)2溶液后,生成沉淀2,则沉淀2可能为BaCO3和BaSO3或两者其一即原溶液中一定含有CO32-和SO32-或两者之一,则溶液2中可能有:Na+、K+、Cl-,一定含Ba2+、OH-,加入过量的硝酸和硝酸银,生成沉淀3,则说明原溶液中含Cl-,由于溶液一定呈电中性,则溶液中一定含Na+和K+或两者中的一种,以此解答该题.
解答 解:溶液加入过量的溶液后,生成沉淀1,由题意可知原溶液中一定有AlO2-;所得溶液I中加入过量的Ba(OH)2溶液后,生成沉淀2,则沉淀2可能为BaCO3和BaSO3或两者其一即原溶液中一定含有CO32-和SO32-或两者之一,则溶液2中可能有:Na+、K+、Cl-,一定含Ba2+、OH-,加入过量的硝酸和硝酸银,生成沉淀3,则说明原溶液中含Cl-,由于溶液一定呈电中性,则溶液中一定含Na+和K+或两者中的一种,
A.沉淀2可能为BaCO3和BaSO3或两者中的一种,BaSO3放置在空气中会被氧化为BaSO4,则质量会增加,故沉淀2放置在空气中,若质量增加,试样中肯定操作SO32-,故A正确;
B.由于溶液中一定含AlO2-,故向试样溶液中加入稍过量的NH4Cl溶液,AlO2-能和NH4+发生双水解得到Al(OH)3,故B正确;
C.由于溶液中一定含AlO2-和Cl-,一定含有CO32-和SO32-或两者之一,一定含Na+和K+或两者中的一种,故先向溶液中加入过量稀硝酸,会将CO32-反应掉,将AlO2-反应为Al3+,将SO32-氧化为SO42-,再加少量硝酸银,会生成AgCl和Ag2SO4沉淀,则所得的溶液中一定含Na+和K+或两者中的一种,一定含Al3+、NO3-,再向溶液中加入过量的Ba(OH)2溶液,Al3+遇过量的OH-生成AlO2-,无沉淀生成;所得溶液中一定含Na+和K+或两者中的一种,一定含AlO2-和NO3-,再加入过量的NaHCO3,会生成Al(OH)3沉淀,故步骤(1)(2)(3)的顺序改为(3)(2)(1),实验现象不同,故C错误;
D.由以上分析可知试样溶液中肯定操作AlO2-、Cl-,其中Na+、K+至少操作1种,故D正确.
故选C.
点评 本题考查离子的检验方法,为高频考点,侧重学生的分析能力的考查,注意掌握常见离子的性质及检验方法,要求学生能够根据反应现象判断离子存在情况,试题培养了学生灵活应用所学知识的能力,难度不大.

| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
 丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.(1)已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H=-2 741.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
则反应C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)的△H=-2219.9 kJ•mol-1.
(2)某课外活动小组为了探究在相同温度下反应过程中能量变化与化学平衡的关系,将C3H8不完全燃烧的产物CO和H2O(g),通入到体积均为1L的A、B两个密闭容器中,在相同温度下均发生如下可逆反应:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
相关数据如下:
| 容器 编号 | 起始时各物质 的物质的量/mol | 达到平衡 的时间/min | 达到平衡时 体系能量的 变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | 放出热量:36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | 放出热量:Q |
①0~ta时刻,容器A中CO的平均反应速率为$\frac{0.9}{{t}_{a}}$ mol•L-1•min-1,化学平衡常数Ka=1.35;若容器B中反应的平衡常数为Kb,则该温度下Ka等于(填“大于”“小于”或“等于”)Kb.
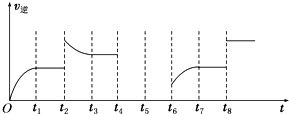
②某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:通过研究图象发现,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,它们改变的条件分别是t2升高温度(或增大CO2的浓度或增大H2的浓度),t8使用催化剂或加压(减小容器的体积).
③测得在容器A中反应进行到t min时,混合气体中CO2的物质的量为0.3mol,若用150mL 3mol•L-1的NaOH溶液将其完全吸收,则所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)CO2溶于水生成H2CO3,已知:常温下,H2CO3和HClO的电离常数如下:
H2CO3?H++HCO${\;}_{3}^{-}$ Ka1=4.2×10-7 mol•L-1
HCO${\;}_{3}^{-}$?H++CO${\;}_{3}^{2-}$ Ka2=5.6×10-11 mol•L-1
HClO?H++ClO- Ka=4.7×10-8 mol•L-1
请写出氯气和碳酸钠在物质的量之比为1:1时发生反应的离子方程式:Cl2+CO32-+H2O═Cl-+HClO+HCO3-.
| A. | 合成氨反应在低温下能够自发进行,是因为反应物键能之和大于生成物键能之和 | |
| B. | 元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属元素 | |
| C. | 人们利用元素周期律在过渡元素中寻找各种性能优良的催化剂,以降低化学反应的活化能,从而起到很好的节能效果 | |
| D. | 超高分辨率荧光显微镜能够观察到纳米尺度的物质,用它可以获得蛋白质溶液中的分子图象 |
| A. | 1、2 | B. | 2、3 | C. | 3、6 | D. | 4、6 |
| A. | 上述元素中,Y的原子半径最大 | |
| B. | 上述元素中,W的气态氢化物最稳定 | |
| C. | 元素W和X可形成含有极性键的极性分子WX3 | |
| D. | 工业上可用电解熔融的Y、Z的化合物的方法冶炼Y、Z的单质 |
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
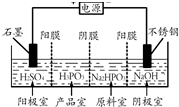 亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.
亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.