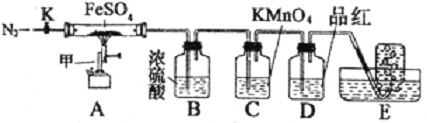
题目内容
【题目】将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)![]() 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(I2)= 。
(2)2min未c(HI)= mol/L。
(3)起始时,c(H2)= mol/L,反应进行到2min时,容器中I2所占的体积分数是_______________。
【答案】(1)0.05mol/(L·min);(2)0.2;(3)0.5,40%。
【解析】
试题分析:(1)同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(H2)=v(I2)=1/2v(HI)=1/2×0.1mol/L.min=0.05mol/(L·min);(2) 2min未c(HI)=v·t=0.1 mol/(L·min) ×2min =0.2mol/L;(3)碘蒸气的起始浓度=2min末碘蒸气浓度+参加反应的碘蒸气浓度=0.4mol/L +0.05 mol /(L·min)×2min =0.1mol/L+0.4mol/L=0.5mol/L,由于开始时H2和I2(g)物质的量相等,所以开始时氢气的物质的量浓度是0.5mol/L;由于该反应是反应前后气体体积相等的反应,容器的容积不变,所以反应进行到2min时,容器中I2所占的体积分数等于其所占的物质的量浓度的比,是[0.4mol/L÷ (0.5mol/L+ 0.5mol/L)]×100%=40%。

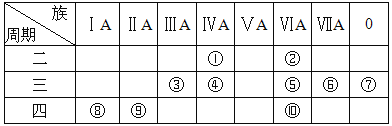
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 和E同主族 |
C | lmo1C单质能与冷水反应,在标准状况下生成11.2LH2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1) A在周期表中的位置为 。
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
A.比较两种单质的颜色
B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置
D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。